糖尿病のGWAS結果
最近のゲノムワイド関連解析(GWAS)では、日本人集団における2型糖尿病に関わる新たな遺伝子領域がいくつか発見されています。例えば、東京大学や理化学研究所などの研究グループは、20万人規模の日本人集団の遺伝情報を用いて、2型糖尿病の危険性を高める遺伝子領域を新たに28箇所同定しました1。
また、GLP-1受容体のミスセンス変異が2型糖尿病の危険性と関わることも見出されました。この変異は、薬剤投与後のインスリン分泌を増加させるため、薬の効き方を予測する指標として応用できる可能性があります1。
これらの研究成果は、2型糖尿病の遺伝要因の理解を深めるだけでなく、将来的には糖尿病の発症予測や発症前予防の応用にもつながることが期待されています
プレスリリース日本人集団の2型糖尿病に関わる新たな遺伝子領域を発見
プレスリリース
東京大学
理化学研究所
大阪大学
東北大学
岩手医科大学
日本医療研究開発機構(AMED)
発表者
山内 敏正(東京大学大学院医学系研究科 内科学専攻 代謝・栄養病態学/医学部附属病院 糖尿病・代謝内科 教授)
鈴木 顕(大阪大学大学院医学系研究科 遺伝統計学 助教(2018年3月までは、東京大学大学院医学系研究科 内科学専攻 代謝・栄養病態学 博士課程))
堀越 桃子(理化学研究所 生命医科学研究センター 腎・代謝・内分泌疾患研究チーム チームリーダー)
鎌谷 洋一郎(理化学研究所 生命医科学研究センター 統計解析研究チーム チームリーダー/京都大学大学院医学研究科 京都大学・マギル大学ゲノム医学国際連携専攻)
岡田 随象(大阪大学大学院医学系研究科 遺伝統計学 教授)
発表のポイント
- 20万人規模の日本人集団の遺伝情報を用いたゲノムワイド関連解析を行い、糖尿病治療薬の標的分子であるGLP-1受容体のミスセンス変異など、2型糖尿病の危険性を高める遺伝的変異を新たに同定しました。
- 2型糖尿病の遺伝において、日本人集団と欧米人集団に共通する、または相違がある分子生物学的パスウェイを明らかにしました。
- 本研究成果は2型糖尿病の遺伝要因の理解を深めるとともに、将来的には糖尿病の発症予測・発症前予防の応用につながることが期待されます。
発表概要
2型糖尿病は脳卒中・心筋梗塞・腎不全・がんなど、万病の危険性を高める重大な病気であり、日本国内で1,000万人、世界中で4億人以上が2型糖尿病と言われています。2型糖尿病のかかりやすさは、遺伝と環境の両方によって影響されますが、日本人集団における2型糖尿病の遺伝の理解は不十分でした。
東京大学大学院医学系研究科の門脇孝特任教授、山内敏正教授、理化学研究所生命医科学研究センターの堀越桃子チームリーダー、鎌谷洋一郎チームリーダー、大阪大学大学院医学系研究科 岡田随象教授、鈴木 顕助教らの研究グループは、20万人規模の日本人集団の遺伝情報を用いた大規模ゲノムワイド関連解析(GWAS、注1)を行い、2型糖尿病の危険性を高める遺伝子領域を新たに28箇所同定しました。また、2型糖尿病治療薬の標的分子であるGLP-1受容体のミスセンス変異(注2)が2型糖尿病の危険性と関わることを見出しました。このミスセンス変異は薬剤投与後のインスリン分泌を増加させるため、薬の効き方を予測する指標に応用できる可能性があります。
2型糖尿病の遺伝において、膵臓のβ細胞(注3)が日本人集団と欧米人集団に共通して重要である一方、インスリン分泌を調節する経路など日本人集団においてより大きな影響を有する分子生物学的パスウェイを見出しました。
これらの結果は2型糖尿病の遺伝要因の理解を深めるとともに、将来的には糖尿病の発症予測・発症前予防に応用できる可能性があります。
本研究は国立研究開発法人日本医療研究開発機構(AMED)のゲノム医療実現推進プラットフォーム事業「先端ゲノム研究開発」(GRIFIN)領域における研究開発課題「糖尿病の遺伝・環境因子の包括的解析から日本発次世代型精密医療を実現するプロジェクト」(研究開発代表者:門脇孝)、「オーダーメイド医療の実現化プロジェクト」の「糖尿病・メタボリックシンドローム関連疾患の個別化医療実現」(研究開発代表者:門脇孝)の一環で行われました。その成果は日本時間2019年2月5日午前1時(米国東部標準時 2019年2月4日午前11時)に米国科学雑誌 Nature Genetics オンライン版に掲載されます。
発表内容
2型糖尿病は、慢性的な高血糖状態が続くことにより、脳卒中・心筋梗塞・腎不全・がんなど、万病の危険性を高める重大な病気であり、遺伝的・環境的要因を含む複数の原因によって引き起こされることが知られています。今日、日本国内で約1,000万人、世界中で4億人以上が2型糖尿病を患っていると推測されており、世界的にも重要な医学的問題となっています。これまでゲノムワイド関連解析(genome-wide association study; GWAS)により、多くの2型糖尿病の危険性を高める遺伝子領域が同定されていますが、これらは主に欧米人集団を対象とした研究で同定されてきました。しかし、ウエスト周囲長または体格指数(body mass index; BMI)が同程度の場合、日本人集団では欧米人集団よりも2型糖尿病発症の危険性が高く、日本人集団と欧米人集団では2型糖尿病の疫学は異なることが知られています。この違いは、2つの民族集団における2型糖尿病の病因が異なる可能性があることを示しています。
そこで日本人集団の2型糖尿病の遺伝素因を解明するために、日本人集団における4種類の2型糖尿病のゲノムワイド関連解析の結果を統合し、メタ解析を行いました(2型糖尿病 36,614例および対照群 155,150例)。本研究で解析対象となった検体はバイオバンク・ジャパン、東北大学東北メディカル・メガバンク機構、岩手医科大学いわて東北メディカル・メガバンク機構、多目的コホート研究、日本多施設共同コーホート研究より提供されました。メタ解析では、88の遺伝子領域がゲノムワイドの有意水準をもって2型糖尿病と関連しており、うち28領域はこれまでに報告のない新規領域でした(図1)。同一領域に存在する複数の独立した関連シグナルを見つけるために、段階的条件付き分析を行ったところ、さらに27個のシグナルを追加で検出し、シグナルの総数は115となりました。
各シグナルにおける原因変異および原因遺伝子についての洞察を得るために、同定した115の2型糖尿病シグナルと重なるミスセンス変異を検索しました。各2型糖尿病シグナルにおいて最も強い関連を示した変異と重なる、28種類のミスセンス変異を同定し、このうち15のミスセンス変異については2型糖尿病との関連が未報告の変異でした。15の新規ミスセンス変異には膵腺房細胞(注4)にだけ発現し、分化を誘導するGP2や、インスリン分泌に関連するインクレチンの一つであるGLP-1の受容体(GLP-1R)が含まれていました。特筆すべきはGLP-1RのR131Q変異(注5)であり、これは日本人集団では多くの人が持っている変異でしたが、欧米人集団ではほとんどの人が持っていない稀な変異でした(図2a, b)。2型糖尿病の危険性を下げるGLP-1R R131Q変異(図2c, d)は、GLP-1によって誘導されるインスリン分泌を2倍以上にすることが報告されており、個人毎の薬剤反応性マーカーとして応用できる可能性があります。また、日本人集団では欧米人集団と比較してGLP-1受容体作動薬を含むインクレチン関連薬の有効性が高いことが知られており、そのメカニズム解明につながる可能性があります。
次に、Roadmap Epigenomicsプロジェクトが提供する細胞や組織におけるエピゲノム(注6)情報を活用し、2型糖尿病のゲノムワイド関連解析の結果と統合する横断的オミックス解析を実施しました。この解析では層別化LDスコア回帰(注7)を用いてそれぞれの細胞・組織のヒストン修飾領域における2型糖尿病の遺伝率(注8)の集積を定量化し、各細胞・組織が2型糖尿病発症に関してどれだけ重要であるかを評価しました。220種類の細胞・組織エピゲノム情報のうち、膵島(注9)のH3K27acにおいて最も強く2型糖尿病の遺伝率が集積していました。H3K27acは遺伝子発現を調節するエンハンサーに特徴的なエピジェネティック修飾であることが知られています。
2型糖尿病と他の疾患や形質との間に共通する遺伝的背景を評価するために、二変量LDスコア回帰(注10)を用いて、日本人集団における2型糖尿病と91の多因子形質(32の多因子疾患および59の量的形質)との間の遺伝的背景の相関関係を計算しました。既に知られている心血管疾患やBMIなどとの相関を認めたほか、2型糖尿病と後縦靭帯骨化症および白血球数との間に有意な正の相関があることを見出しました。
2型糖尿病の遺伝素因における分子生物学的な洞察を得るために、日本人集団と欧米人集団の2型糖尿病GWASを対象に民族横断的な分子生物学的パスウェイ解析(注11)を実施しました(表1)。1,077のパスウェイのうち、日本人集団および欧米人集団において2型糖尿病と有意に関連していたパスウェイ数は、それぞれ17と13でした。特に、若年成人発症型糖尿病(maturity onset diabetes of the young; MODY)に関わるパスウェイが両民族集団において2型糖尿病と最も強く関連していることを世界で初めて見出しました。 MODYはβ細胞機能の障害を特徴とする、たった一つの遺伝子異常により発症する遺伝性の糖尿病です。また、β細胞の発生、発生生物学、前立腺がん、およびG1期に関わるパスウェイも、両方の民族集団において2型糖尿病と関連していました。一方、インスリン分泌調節に関わるパスウェイは、日本人集団においてのみ、2型糖尿病と有意な関連を示しました。
これらの結果は2型糖尿病の遺伝要因の理解を深めるとともに、将来的には糖尿病の発症予測・発症前予防に応用できる可能性があります。
本研究の論文投稿中に2型糖尿病の感受性領域に関する研究が複数報告され、本研究で同定した新規2型糖尿病感受性領域の一部と重なりが認められました(文献1~4)。特に、ごく最近発表された欧米人集団の2型糖尿病を対象とした90万人規模のGWAS(文献1)では、新規に135領域が報告されていますが、本研究グループが日本人集団で新規に同定した28領域との重なりは8領域のみでした。残り20領域は日本人集団におけるGWASにおいてのみ有意な関連が認められる領域であることが確認されました。
共同研究グループはまず、1万1097人の日本人2型糖尿病患者のゲノムを用いて、一塩基多型(SNP)の網羅的な解析を行いました。この解析は糖尿病網膜症GWASとしては世界最大規模のものです。具体的にはバイオバンクジャパン[6]に登録されている2型糖尿病患者のうち、糖尿病網膜症を発症した5,532人、網膜症を発症していない5,565人のゲノムDNAサンプルを用いて、GWASを行いました(図1)。
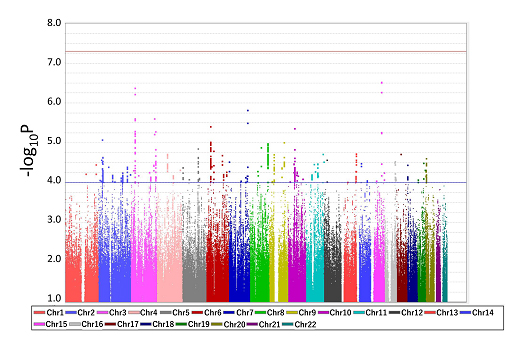
図1 糖尿病網膜症のゲノムワイド関連解析(GWAS)の結果
各SNPと糖尿病網膜症の関連を調べるゲノムワイド関連解析の結果。横軸にヒトゲノム染色体上の位置、縦軸に各SNPの糖尿病網膜症との関連の強さを示した。グラフの上にあるほど関連が高いことを示す。青の実線より上に位置する85か所について検証解析を行った。
ヒトゲノム全体をカバーする約580万カ所のSNPの中から、糖尿病網膜症の発症に関わると考えられる有力な85カ所を選び、さらに別の日本人2型糖尿病患者(糖尿病網膜症群2,260人、対照群723人)を追加して検証解析を行いました。そして、GWASと検証解析の結果をメタ解析[7]で統合した結果、二つのゲノム領域(STT3BおよびPALM2)が糖尿病網膜症の疾患感受性とゲノムワイド水準(p = 5×10-8)[8]を超える関連を持つことを発見しました(図2)。
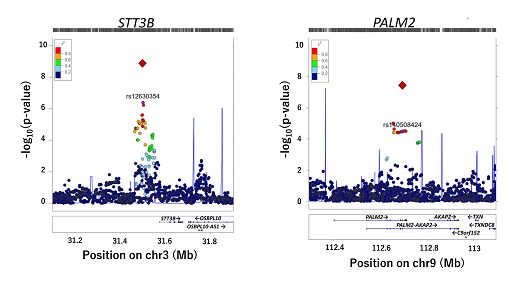
図2 糖尿病網膜症と関連する二つのゲノム領域
横軸にヒトゲノム染色体上の位置、縦軸に各SNPの糖尿病網膜症との関連の強さを示した。赤のダイヤモンド(◆)はGWASと検証解析の結果を統合したメタ解析で、rs12630354(STT3B)およびrs140508424(PALM2)の関連がゲノムワイド水準(p = 5×10-8)を超えたことを示す。
さらに、1万1097人の網羅的なSNPデータを用いてgene-based association analysis[9]という統計学的手法により、糖尿病網膜症とSNPの関連を遺伝子単位で解析しました。1万8480個の遺伝子を対象に解析した結果、EHD3遺伝子が糖尿病網膜症発症と関連することが明らかになりました(図3)。
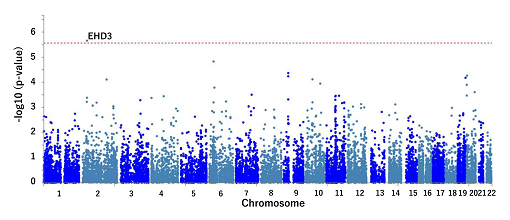
図3 遺伝子単位での関連解析
遺伝子ごとの糖尿病網膜症の関連について網羅的に検討を行った。図では一つの点が遺伝子を意味しており、横軸に染色体上の位置、縦軸に遺伝子の関連の強さを示している。赤い点線はこの解析での有意水準を示す。EHD3遺伝子が糖尿病網膜症発症に関連していることが分かった。
今後の期待
本研究により、糖尿病網膜症との関連が明らかになった二つのゲノム領域(STT3BおよびPALM2)やEHD3遺伝子がどのように糖尿病網膜症発症に関わるか、そのメカニズムを解明することで、糖尿病網膜症に対する新しい治療薬の開発に貢献する可能性があります。
また、今後GWASの研究をさらに推進することで、糖尿病網膜症に関連するSNPの情報を組み合わせて糖尿病網膜症発症の傾向を予測し、遺伝的リスクに応じた予防対策を講じる精密医療[10]につながると期待できます。
2024年11月15日 | カテゴリー:糖尿病 |





