PKMについて
Pyruvate kinase isozymes M1/M2 (PKM1/M2),
also known as pyruvate kinase muscle isozyme (PKM), pyruvate kinase type K, cytosolic thyroid hormone-binding protein (CTHBP), thyroid hormone-binding protein 1 (THBP1), or opa-interacting protein 3 (OIP3),
is an enzyme that in humans is encoded by the PKM2 gene.
PKM2 is an isoenzyme of the glycolytic enzyme pyruvate kinase.
Depending upon the different metabolic functions of the tissues, different isoenzymes of pyruvate kinase are expressed.
PKM2 is expressed in some differentiated tissues, such as lung, fat tissue, retina, and pancreatic islets, as well as in all cells with a high rate of nucleic acid synthesis, such as normal proliferating cells, embryonic cells, and especially tumor cells.
The discovery of PKM2 began with laboratory observations made by Otto Heinrich Warburg, a German physiologist and Nobel Laureate in Physiology or Medicine in 1931.[16][17]
Warburg's experiments show that the cells exhibit dependence on glucose and are capable of fermentation, even under aerobic conditions.
These observations are known as the Warburg effect.
Subsequent research on the metabolic demands of cancer cells, studies have been directed towards the investigation of specific subtypes of pyruvate kinase, notably M1 and M2.

Cellular uptake of glucose occurs in response to insulin signals, and glucose is subsequently broken down through glycolysis, lowering blood sugar levels.
However, insulin resistance or low insulin levels seen in diabetes result in hyperglycemia, where glucose levels in the blood rise and glucose is not properly taken up by cells. Hepatocytes further contribute to this hyperglycemia through gluconeogenesis. Glycolysis in hepatocytes controls hepatic glucose production, and when glucose is overproduced by the liver without having a means of being broken down by the body, hyperglycemia results.[50]
Malignant tumor cells perform glycolysis at a rate that is ten times faster than their noncancerous tissue counterparts.[51] During their genesis, limited capillary support often results in hypoxia (decreased O2 supply) within the tumor cells. Thus, these cells rely on anaerobic metabolic processes such as glycolysis for ATP (adenosine triphosphate). Some tumor cells overexpress specific glycolytic enzymes which result in higher rates of glycolysis.[52] Often these enzymes are Isoenzymes, of traditional glycolysis enzymes, that vary in their susceptibility to traditional feedback inhibition. The increase in glycolytic activity ultimately counteracts the effects of hypoxia by generating sufficient ATP from this anaerobic pathway.[53] This phenomenon was first described in 1930 by Otto Warburg and is referred to as the Warburg effect. The Warburg hypothesis claims that cancer is primarily caused by dysfunctionality in mitochondrial metabolism, rather than because of the uncontrolled growth of cells. A number of theories have been advanced to explain the Warburg effect. One such theory suggests that the increased glycolysis is a normal protective process of the body and that malignant change could be primarily caused by energy metabolism.[54]
This high glycolysis rate has important medical applications, as high aerobic glycolysis by malignant tumors is utilized clinically to diagnose and monitor treatment responses of cancers by imaging uptake of 2-18F-2-deoxyglucose (FDG) (a radioactive modified hexokinase substrate) with positron emission tomography (PET).[55][56]
There is ongoing research to affect mitochondrial metabolism and treat cancer by reducing glycolysis and thus starving cancerous cells in various new ways, including a ketogenic diet.
がん細胞は、自由に増殖できるようにするため、根本的な部分で多くの変化を起こしている。驚くべきことに、エネルギーをつくり出す経路の再プログラミングもそのような変化の一つである。正常な細胞の場合、ブドウ糖(glucose)をエネルギーに変換する過程は、細胞質における解糖系(glycolysis)から始まる。解糖系の最後に生成されるピルビン酸(pyruvate)は、通常ミトコンドリアに入ってクエン酸回路(citric acid cycle)に進む。酸素があると、この回路は電子伝達系(electron transfer chain、複合体I、III、IV)とATP合成酵素(ATP synthase)の働きによる好気性なエネルギー産生を促進する。がん細胞は大量のブドウ糖を取り込むが、解糖の最終段階はブロックしている。これらの細胞で作られたピルビン酸は、ミトコンドリアに入いっていくのではなく、乳酸へ変換される。
ピルビン酸キナーゼM2: 門番
解糖の最終段階は、ピルビン酸キナーゼ(pyruvate kinase、PDB ID 4fxf)という酵素によって触媒される。この酵素は、ホスホエノールピルビン酸(phosphoenolpyruvate)からリン酸基を転移させ、ATP(細胞のエネルギー通貨)とピルビン酸をつくる反応を触媒している。細胞の生存に不可欠であるため、ピルビン酸キナーゼの活性は厳重に制御されている。この酵素は、高活性型4量体と低活性型2量体の2種類の集合体をつくる。より多くのエネルギーが必要なときは、フルクトース2リン酸(fructose bisphosphate、解糖系のより前の段階で生成される分子)が4量体形成を促進する。一方、他の様々な制御分子が、特定のアロステリック部位(活性部位とは別の場所だが活性に影響を与える部位)に結合して2量体形成を促し酵素活性を抑えることができる。体内では4種類の組織特異的なピルビン酸キナーゼが作られる。PKM1は多くのエネルギーを必要とする細胞で、PKRは赤血球で、PKLは肝細胞で、PKM2は通常胚細胞やその他増殖中の細胞で作られる。PKM1酵素は一般に4量体の形で存在し、常に活性のある状態になっている。しかし、多くのアロステリック制御分子がPKM2酵素と結合し、酵素が4量体から2量体への移行に影響を与えることでその作用を制御している。がん細胞はこの制御を利用し、自らの代謝のしくみを作り直している。
エネルギー産生のパラドックス
多くのがん細胞は、酵素のピルビン酸キナーゼM2(PKM2)を大量につくり、エネルギー産生経路を解糖系に移行させている。この代謝の作り直しは、2つの理由から逆説的である。第一に、これらの細胞は酸素が豊富にあっても好気性エネルギー産生を行わない。第二に、これらの急速に分裂する細胞は正常細胞より多くのエネルギーを必要とするのに、エネルギー効率の著しく悪い解糖を主なエネルギー源として使用している。この相反する挙動に対する答えは、PKM2の速度を低下させたることによって生じる別の代謝産物にある。すなわち、解糖系における前段階でできる代謝中間体が蓄積されることにある。これらの中間体は多くの生合成経路に転用され、がん細胞は急速な成長に必要なタンパク質や核酸の構築部材をつくることができる。このように、がん細胞はエネルギー産生よりも成長を優先させる。このようなブドウ糖利用の再プログラミングは、ワールブルグ効果(Warburg Effect)と呼ばれている。この名称は、これを発見した研究者オットー・ハインリッヒ・ワールブルグ(Otto Heinrich Warburg)の名にちなんで名づけられたものである。
ワールブルグ効果とがん治療
ワールブルグ効果は、腫瘍形成における共通の特徴である。その発見以来、がん細胞ではPKM2がリン酸化およびアセチル化されていることが見いだされてきた(PDBエントリー6wp3)。これらの修飾は、フルクトース2リン酸などの活性化因子が結合する部位に影響を与える。これらの活性化因子がなければ、PKM2は効率よく高活性な4量体を形成することができない。この酵素の2量体は、解糖において活性が低いだけでなく、核内に移動して他のがんを引き起こす遺伝子の転写を促進することがある。このような変化は、乳酸の蓄積を引き起こし、腫瘍の進行やがん治療への耐性を助長することになる。PKM2はがん細胞の再プログラミングに重要な役割を果たすため、現在、PKM2を阻害する薬剤や治療法、あるいは好気性代謝を活性化する別の方法を模索する研究が行われている。
構造をみる
。
PKM2 4量体の構造から、さまざまな低分子がアロステリックな形状変化を引き起こし、タンパク質の作用を制御していることが明らかになった。左に示すのが活性型(PDB ID 4fxf)で、ATP、シュウ酸(oxalate)、マグネシウム(magnesium)が活性部位に、フルクトース2リン酸(fructose bisphosphate、FBP)が制御部位にある。中央に示すのが不活性型(PDB ID 6gg3)で、制御部位にはアラニンがある。形状が変化し、中央部が細くなっていることに注目してほしい。がん治療に役立てるため、PKM2に結合する薬物分子を探す研究が積極的に行われている。例えば、右に示す構造(PDB ID 3me3)では、人工の活性化分子(赤紫色)がFBPとともに結合しているが、これにより分子を活性型に変化させ、この分子で処理した細胞でウォーバーグ効果を逆転させることができると期待されている。
がんにはグルコースが好気的に代謝されにくいというWarburg効果があるが,その意義についてはよくわかっていない.この研究において,筆者らは,Warburg効果の鍵をにぎる解糖系の酵素ピルビン酸キナーゼMの新たな遺伝子改変マウスを作出することなどにより,Warburg効果には細胞の生存あるいは増殖に対しむしろ不利にはたらく面のあることを明らかにした.ピルビン酸キナーゼMには選択的スプライシングにより産生される2つのアイソフォームPkm1およびPkm2が存在し,そのうち,Pkm2の選択的な発現がWarburg効果の成立には必須とされており,ほとんどのがん細胞はPkm1ではなくPkm2を圧倒的に高く発現する.ところが,マウスにおける発がん実験や移植モデルにおける解析において,Pkm1はPkm2よりもがんの増殖を促進することがわかった.Pkm1はPkm2と比べ代謝活性が高く,そのため,グルコース代謝の全般を亢進する.小細胞肺がんを典型とする肺神経内分泌腫瘍においてはPkm1の発現が高く,このPkm1の発現は小細胞肺がんの増殖に必須であった.これらの結果は,Pkm2によるグルコース代謝の制限が発がんに必須であるという定説に対する強い反証となるとともに,肺神経内分泌腫瘍のような一部のがんにおいてPkm1やその関連する形質が新たな治療の標的になる可能性が示された.
はじめに
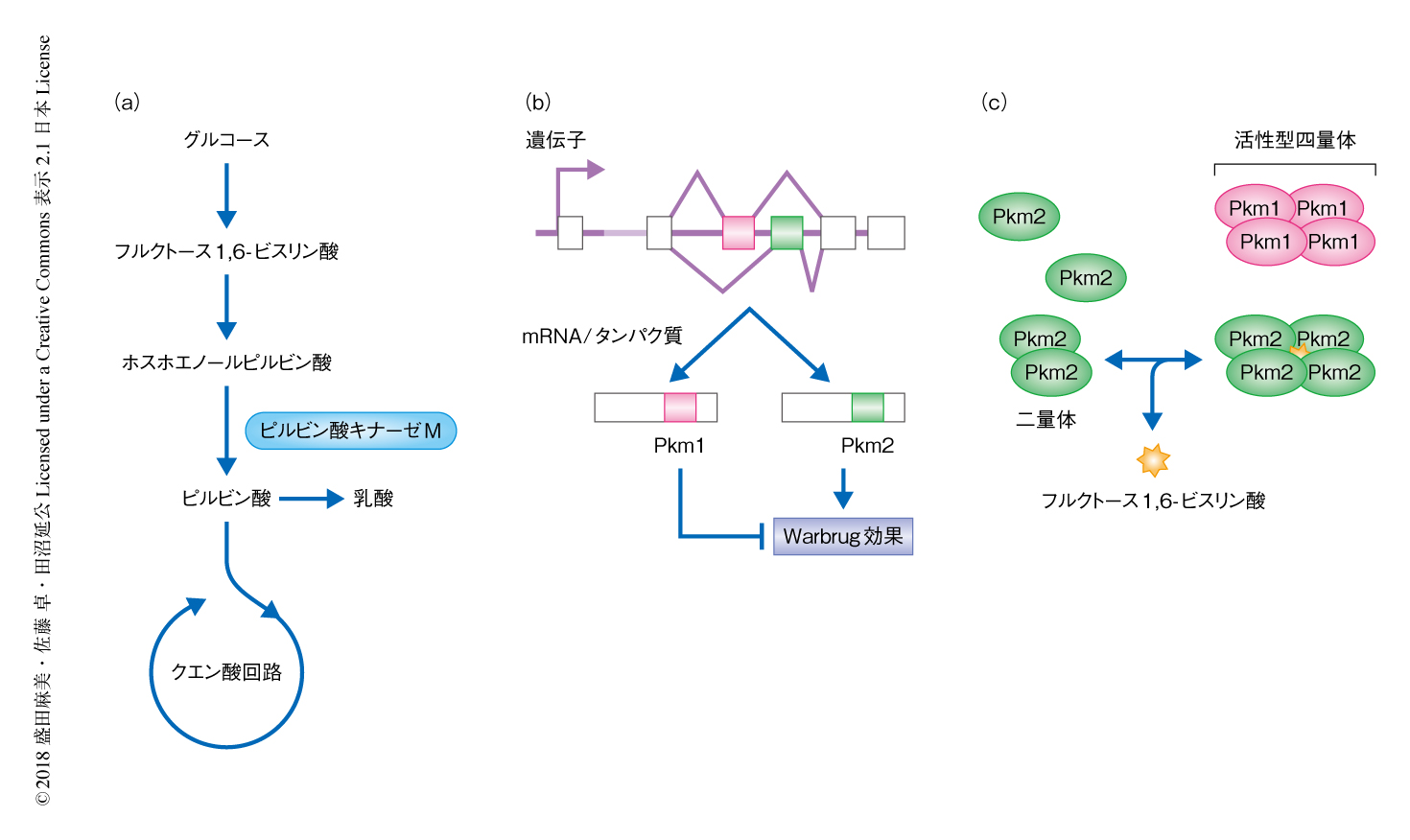
がん細胞が大量のグルコースを取り込むことは疑いない.大量に取り込まれたグルコースはグルコースが好気的に代謝されにくいというWarburg効果にしたがい,ミトコンドリアにおけるクエン酸回路などの異化反応よりも核酸やNADPHの生合成に動員される.そうすることにより,がんは代謝のメリットを多く享受しているというのがこれまでのもっとも一般的な解釈と思われる. この仮説がつくられる過程において大きな役割をはたしたもののひとつが,がんとPkm2のストーリーである1).ピルビン酸キナーゼMは解糖系の最終の段階,ホスホエノールピルビン酸からピルビン酸への反応を触媒する(図1).この酵素には選択的スプライシングにより産生される2つのアイソフォームPkm1およびPkm2が存在し,このうち,Pkm2の選択的な発現がWarburg効果に必須とされる.脳や筋肉などにおいておもに発現するPkm1が構成的な高活性型なのに対し,通常,Pkm2は活性が低く維持されており,Pkm2の活性化には解糖系の中間産物であるフルクトース1,6-ビスリン酸などのアロステリック因子が必要になる.そのため,Pkm2を発現する細胞においてはグルコースに由来する炭素のクエン酸回路への流入が制限される.Pkm2がグルコースからクエン酸回路への流入を抑制しつつ,なぜ,乳酸の産生を促進させるのかは完全な謎である.
(a)ピルビン酸キナーゼMは解糖系においてフルクトース1,6-ビスリン酸からピルビン酸への反応を触媒する.
(b)ピルビン酸キナーゼMの選択的スプライシングによるアイソフォームの産生.
(c)Pkm1とPkm2の活性の制御の違い.
[Download]
ともかくも,大半のがん細胞がPkm2を高く発現することは,がんの一般的な性質としてのWarburg効果と符合するとみられている1).当初,Pkm2のもたらすWarburg効果はがんの増殖を促進すると考えられてきた2).ところが,いくつかの実験的な発がんモデルにおいて,Pkm2ノックアウトマウスにてがんの促進が示された3-5).それらをうけ,Pkm2およびWarburg効果はがんに対し本当に促進的といえるのか,疑問の声があがっていた.
1.Pkm1はPkm2よりも細胞自律的にがんの増殖を促進する
Pkm遺伝子のエキソン10を欠失させたPkm2ノックアウトマウスにおいては,Pkm2の欠損とともに代償的なPkm1の発現が起こる3,4).しかし,その代償的なPkm1の発現量と,もともとのPkm1およびPkm2の発現量とのあいだにはへだたりがあり,そのため,このモデルにおいてPkm1とPkm2の機能を比較するのは困難であった.この問題を解決するため,新たにピルビン酸キナーゼMの選択的スプライシングが起こらないマウスを作出した.すなわち,Pkm1をコードするcDNAあるいはPkm2をコードするcDNAの後半の部分をポリA付加シグナルとともにエキソン8の途中にシームレスにノックインした.これらのノックインマウスはPkm1あるいはPkm2のいずれか片方のみをほぼ同じレベルで発現した.Pkm1ノックインマウスおよびPkm2ノックインマウスはいっけん正常に生育し繁殖も可能であった. これらのノックインマウスを用いてKras遺伝子に依存的な肺発がん実験,あるいは,全身性の化学発がん実験を実施したところ,Pkm1ノックインマウスにおいては,野生型のマウスあるいはPkm2ノックインマウスと比べ,がんの発生や進展が促進されることがわかった.これらのノックインマウスに由来する胎仔線維芽細胞および肺上皮細胞を用いた形質転換および移植実験から,Pkm1によるがんの促進作用はがん細胞に自律的なものと考えられた.
2.Pkm1はグルコース代謝を亢進させる
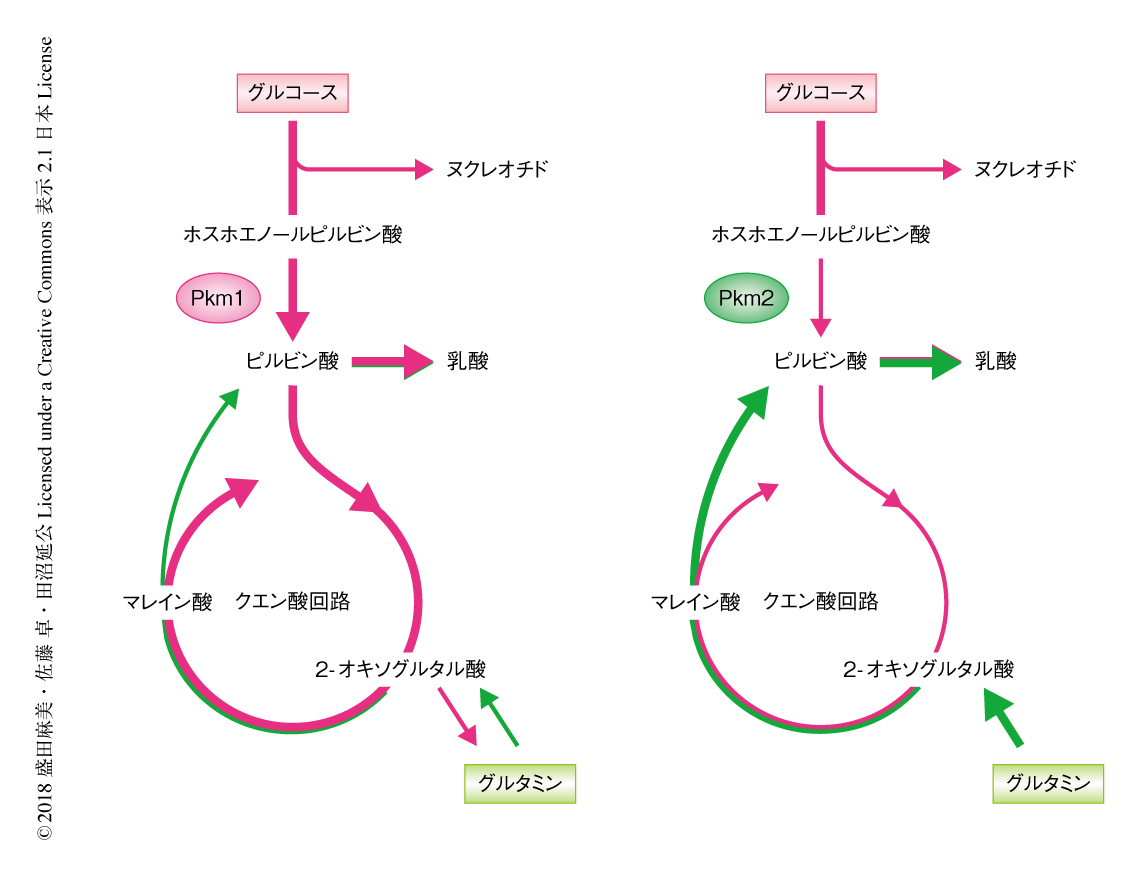
Pkm1を発現する細胞とPkm2を発現する細胞の代謝を比較するため,形質転換したマウス胎仔線維芽細胞において13Cにより標識したグルコースを用いてトレーサー実験を実施した.その結果,グルコースに由来する炭素のクエン酸回路への流入がPkm1により促進されていた.また,これまで提唱されていたモデルとは異なり1,4),Pkm1により核酸や各種のアミノ酸の生合成がさまたげられることはないこともわかった. また,グルコースに由来する乳酸の産生もPkm1により促進されたが,Pkm1あるいはPkm2と乳酸の産生の制御については少々複雑であった.Pkm1によりグルコースから乳酸への変換が亢進される一方,これまでの報告と一致して2),細胞において産生される乳酸の総量はPkm2ノックインマウスに由来する細胞のほうが高い傾向にあった.つまり,Pkm2はグルコースに由来する乳酸の産生を制限しつつ,ほかの炭素源からの乳酸の産生を促進することが示唆された. これらの結果の原因を探るため,13Cにより標識したグルタミンを用いてトレーサー実験を実施した.Pkm2ノックインマウスに由来する細胞においては,Pkm1ノックインマウスに由来する細胞と比べ,グルタミンがアスパラギン酸,ピルビン酸,アラニン,乳酸へとより活発に代謝されていることがわかった(図2).
[Download]
以上から,Pkm1が各種の生体成分の生合成をさまたげることなくグルコースの異化を亢進すること,一方で,栄養源としてのグルタミンの利用を減弱させることが明らかにされた.
3.Pkm1はオートファジーおよびマイトファジーを促進する
エネルギーの好気的な産生を担うミトコンドリアには,その電子伝達系の機能が低下した場合,活性酸素を生じて細胞に損傷をあたえてしまうという面がある.Pkm1あるいはPkm2によるエネルギー代謝への影響をより詳細に調べるため,Pkm1ノックインマウスあるいはPkm2ノックインマウスに由来する肺上皮細胞のミトコンドリアを解析した.その結果,Pkm2ノックインマウスに由来する肺上皮細胞には,活性酸素を発生しやすい劣化したミトコンドリアが蓄積していることが示唆された.また,ストレス条件のもとや移植したがんなどにて,Pkm1ノックインマウスに由来する肺上皮細胞においては必須アミノ酸を中心に各種のアミノ酸の量が高く維持されていた.これらの結果から,Pkm1がオートファジーおよびマイトファジーを促進することが示唆された. そこで,Pkm1ノックインマウスに由来する細胞およびPkm2ノックインマウスに由来する細胞において,オートファジーに必須とされるATG7をゲノム編集技術を用いて欠損させた.ATG7の欠損によりPkm1ノックインマウスに由来する胎仔線維芽細胞のがん原性が大きく損なわれたことなどから,がんの増殖においてオートファジーあるいはマイトファジーは促進的な作用をもつことがわかった.一連の結果から,Pkm1はオートファジーを亢進し,この面においてもがんに代謝におけるメリットをもたらすことが強く示唆された.
4.肺神経内分泌腫瘍のPkm1に対する依存性
小細胞肺がんを典型とする肺神経内分泌腫瘍はすべての肺がんのうち15~20%をしめる.それ以外の肺がんと比べ,初回の抗がん剤治療あるいは放射線治療が効きやすい傾向にあるが,その大半は再発をきたし,予後はむしろ悪い.マウスの正常な組織においてPkm1あるいはPkm2の発現を注意深く解析することにより,正常な肺気管支の神経内分泌細胞は上皮細胞の系列としては例外的にPkm1を発現することが見い出された.最近の研究により,この細胞は肺神経内分泌腫瘍の起源となる細胞と考えられている6).そこで,肺神経内分泌腫瘍におけるPkm1およびPkm2の発現を調べ,そのほかのがん種における発現と比較した. 手術により得た検体の検討においては,腺がんや扁平上皮がんなどそれ以外の肺がんと比べ,肺神経内分泌腫瘍においてはPkm1 mRNAのレベルが高く,Pkm1とPkm2の比も有意に高かった.細胞株の解析においても,肺神経内分泌腫瘍に由来する細胞株はそれ以外の細胞株と比べ,いちじるしく高いPkm1の発現量,また,Pkm1とPkm2の比を示した.これらの結果から,腺がんや扁平上皮がんと比べ,肺神経内分泌腫瘍においてはPkm1の発現量が高く,その性質は株化ののちも維持されることが明らかにされた. 質量分析を用いた絶対定量により,小細胞肺がん細胞株においてPkm1がPkm1とPkm2の合計にしめる割合は16~40%ともとめられた.つまり,小細胞肺がん細胞株においてはPkm1とPkm2が混在することになる.そのような状況において,多量体の形成によるPkm1あるいはPkm2の活性の制御はどうなっているのかを検討した.すると,小細胞肺がん細胞株においては,アロステリック因子の低下をひき起こすグルコース飢餓の条件においてもPkm2が四量体として存在することがわかった.in vitroにおける再構成実験などから,Pkm1とPkm2が共存すると両者はアロステリック因子なしに活性型の四量体を形成することがわかった.これらの結果から,Pkm1にはPkm2を活性化する能力のあることが示唆された. 小細胞肺がんにおけるPkm1の発現の意義について調べるため,ヒトの小細胞肺がん細胞株を親株として,Pkm1あるいはPkm2の一方を同じ程度に発現する細胞株を作製し,その増殖について調べた.その結果,Pkm2を単独で発現する細胞においては増殖はいちじしく減弱していた.したがって,少なくとも検討した小細胞肺がん細胞株においては,Pkm1に起因する高いピルビン酸キナーゼ活性が増殖あるいは生存の維持に必須であることが示唆された.
おわりに
がんとピルビン酸キナーゼMのアイソフォームの制御をめぐっては議論がつづいていたが,がんにおいて,Pkm1はPkm2よりも細胞自律的に増殖を促進することがいくつもの実験系において明らかにされた.また,これまで,増殖している細胞においては発現しないとされていたPkm1がヒトのがんの一部のサブセットにおいて高く発現し,それらがん細胞の増殖あるいは生存をささえていることが明らかにされた.少なくとも,グルコースの好気的な代謝の抑制は各種の生体成分の生合成の維持に必須という従来の仮説は再考する必要があるだろう.実際に,最近,がんにおいてはクエン酸回路が正常な組織を比べより活発であるという報告が主流になりつつある7,8). Pkm1によるがんの促進作用は,これまで,グルコース代謝の全身性の異常によるとされてきたPkm2ノックアウトマウスにおいてみられるがんの促進の現象を3,5),うまく説明するように思われた.この研究においては,少なくとも形質転換したマウス胎仔線維芽細胞あるいは肺上皮細胞において,Pkm1によるグルコースの異化の亢進はオートファジーおよびマイトファジーの活性化を介してアミノ酸の量の維持や劣化したミトコンドリアの除去に貢献することが示唆された.一般に,オートファジーは栄養(とくに,アミノ酸)飢餓に対する応答と考えられており,予想外であった.現時点において,Pkm1がオートファジーを活性化する機序はよくわかっておらず,今後,明らかにする必要があると思われる.ところで,Pkm2については非代謝性の機能も多く報告されていて,それらのほとんどはPkm2に特異的とされている9,10).しかし,この研究においては,Pkm2の非代謝性の機能について,たとえば,HIF-1との協調やSTAT3のリン酸化への貢献は確認されなかった. この研究においてPkm1の重要性が確認された小細胞肺がんを含む肺神経内分泌腫瘍の治療をめぐっては,この15~20年のあいだ,根本的な進歩がなかった.近年の大規模なゲノム解析により,肺神経内分泌腫瘍におけるTP53遺伝子やRb1遺伝子の同時の機能の欠損が明らかにされたが,同時に,現時点で創薬の可能なゲノム変異はほとんど存在しないことも明らかにされている11).
2024年7月9日 | カテゴリー:自然科学的基礎知識//物理学、統計学、有機化学、数学、英語, 生活習慣病, 糖尿病, 慢性腎臓病 |