膵臓癌の危険因子


BRCA1タンパク質またはBRCA2タンパク質を作り出す遺伝子のどちらか一方に変化が起こると、
2023年2月現在、乳がんと卵巣がん、前立腺がん、膵がんの患者さんには、BRCA遺伝子の変化に対応した保険適用の薬剤があります。
ントの保有者は0.31%で、ATMは、ゲノム切断のセンサーであり、P53 腫瘍抑制転写因子をリン酸化によ
って活性化します。ATMは、DNA複製時にゲノム切断修復を促進しています。以上2つの、ATMによる腫瘍抑制機構
はすべての細胞において機能しています。
p16:正常なヒトの体細胞をin vitroで培養すると一定の回数細胞分裂を繰り返した後に分裂寿命を迎え細胞分裂を不可逆的に停止します。
近年、分裂寿命のみならず癌遺伝子の発現、酸化的ストレス、DNAダメージなど様々な発癌の危険性のあるストレス(発癌ストレス)によっても細胞老化と類似の増殖停止が誘導されることが明らかになり、
細胞老化は発癌の危険性を排除するために働く安全装置(癌抑制機構)である可能性が指摘されています(図-1)。
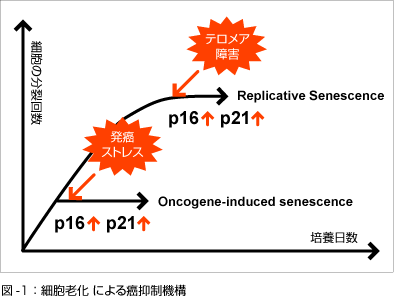
細胞老化の誘導に癌抑制遺伝子であるp16INK4a遺伝子が重要な役割を果たしており、発癌ストレスに反応して発現し、
細胞老化を誘導することにより、異常細胞の増殖を防いでいることが明らかにされてきました
(Hara et al., Mol. Cell. Biol., 1996; Ohtani et al., Nature, 2001; Ohtani et al., J. Cell Biol., 2003) 。
その一方で、p16INK4a遺伝子発現及びそれに伴う細胞老化の誘導は培養条件に大きく影響を受けることから、細胞老化の生体内での役割については懐疑的な意見もありました。
しかし、最近、幾つかの良性腫瘍でp16INK4a遺伝子の発現亢進と細胞老化の形態的特徴が観察され、細胞老化が生体内でも起こりうる現象であることが認識されるようになってきました (Sharpless & DePinho, Nature, 2005)。
更に、p16INK4a遺伝子ノックアウトマウスを用いた解析から、p16INK4aが幾つかの組織幹細胞において加齢による自己複製能の低下の原因となっていることが報告され(Beausejour & Campisi, Nature 2006)、細胞老化の生体内での役割、「特に癌抑制と個体老化における役割」、が再び注目されています。
PRSS:膵臓から分泌される消化 酵素(食べ物を溶かす酵素)であるトリプシンの活性化と不活性化に関わる遺伝子 遺伝性膵炎の原因遺伝子でもある
遺伝性膵炎とは、遺伝により慢性膵炎が家族の中に多発する稀な病気です。遺伝性膵炎の定義として欧米では、①第一度近親者(親子、兄弟姉妹)に2人以上または血縁者に3人以上の膵炎症例を認め、②若年発症、③大量飲酒など慢性膵炎の成因と考えられるものが認められず、④2世代以上で患者が発生していることを挙げています。我が国では少子化に伴い明確な家族歴を得ることが困難なため、厚生労働省難治性膵疾患に関する調査研究班が策定した独自の臨床診断基準に基づき診断されます。
2005年から2014年の間に全国の病院を受診した患者さんを対象とした全国調査では、100家系271症例(男性153例、女性118例)が報告されています(回答率57.2%)。この結果をもとに、我が国における遺伝性膵炎の患者数は300-500人程度と推計されています。
遺伝性膵炎自体は遺伝子の変異によるものと考えられていますので、家族や親戚で膵炎の方が多い場合、通常の膵炎ではなく遺伝性膵炎の可能性があります。
膵臓から分泌される消化 酵素 (食べ物を溶かす酵素)であるトリプシンの活性化と不活性化に関わる遺伝子の変異が主な原因であることが明らかとなっています。最も多い遺伝子変異は、トリプシンの前駆体であるカチオニックトリプシノーゲン(PRSS1)遺伝子の変異で、我が国における遺伝性膵炎家系の約4割が該当します。次に多いのが、トリプシンの働きを抑える膵分泌性トリプシンインヒビター(SPINK1)遺伝子の変異で、約3割の家系が該当します。一方、残りの3割弱の家系では、原因となる遺伝子変異は見つかっていません。
原因となる遺伝子の変異がある場合には遺伝します。しかし、遺伝子の変異があっても、全員が遺伝性膵炎になるわけではありません。カチオニックトリプシノーゲン遺伝子変異を有する場合、8割から9割の方が遺伝性膵炎を発症するとされます。
幼少期より腹痛、 悪心 、嘔吐、下痢などの急性膵炎様発作を繰り返し、多くは慢性膵炎へと進行します。慢性膵炎になると、膵臓から消化酵素が十分に出なくなり三大栄養素の消化吸収障害による 脂肪便 や下痢、体重減少をきたす膵外分泌機能不全や、インスリンの分泌が低下することによる糖尿病を高率に合併します。
原則として通常の慢性膵炎と同じ治療をします。慢性膵炎治療の基本は、“患者さんの背景(成因)をふまえ、臨床経過上の各病期に出現する症状とその重症度、活動性( 再燃 と 寛解 )に応じて集学的に治療する”ことにあります。すなわち、腹痛や急性膵炎の発作が症状の中心である代償期においては急性増悪の予防と腹痛のコントロール、膵臓の機能が低下した非代償期には消化吸収障害ならびに糖尿病の治療といった、膵外内分泌機能の適切な是正が治療の中心となります。一方、慢性膵炎は多分に生活習慣病的な側面があります。したがって治療においては、①断酒、禁煙といった生活指導、②病期に応じた食事指導・栄養管理、③薬物療法、④内視鏡(胃カメラ)による膵石や膵管 狭窄 の治療、⑤外科手術が治療の柱となります。薬物療法や内視鏡治療などを考える際には、生活指導や栄養指導の徹底が前提になります。
発症は幼少期であることが多く、腹痛、悪心、嘔吐、下痢などの急性膵炎様発作を繰り返し、多くは慢性膵炎へと進行します。慢性膵炎になると、膵臓から消化酵素が十分に出なくなり脂肪便や下痢、体重減少を起こす膵外分泌機能不全やインスリンの分泌が減少することによる糖尿病を高率に合併します。頻回な膵炎発作や疼痛コントロールのために頻回の入院や内視鏡(胃カメラ)を用いた治療、外科手術が必要となる症例も少なくありません。
飲酒や喫煙は、膵炎の進行のみならず膵癌のリスクを上昇させますので、厳に控えるべきです。食事に関しては、病気の時期に応じた注意が必要です。すなわち、腹痛発作が症状の中心で、膵臓の働きが保たれている代償期と呼ばれる時期で腹痛がある時期には短期的な脂肪の制限を、一方、腹痛発作がなくなり、膵臓の消化やインスリン分泌といった働きが悪くなった非代償期と呼ばれる時期では、過度な脂肪制限は栄養やビタミン不足をおこしてしまうため、高力価の膵消化酵素薬を内服しながら、十分な栄養を摂ることが大切です
MLH1は細胞複製時のDNAポリメラーゼによる新生鎖形成において生じる塩基対エラーの修復(ミスマッチ修復)に働きます。
修復反応は、ミスマッチ部位がMSH2/MSH3またはMSH2/MSH6複合体により認識されところから始まり続いて、その部位にMLH1/PMS2複合体が結合し、PMS2のエンドヌクレアーゼ活性により新生鎖にニックが入る。
そして最後に、EXO1エキソヌクレアーゼが動員され新生鎖の塩基除去が行われた後に、ポリメラーゼδにより複製が行われ完了します。
このミスマッチ修復に関わるMLH1, MSH2, MSH6そしてPMS2において機能喪失を引き起こす変異は、ミスペアや単純な繰り返し配列の挿入・欠失を引き起こします。そのため、マイクロサテライト領域 (1から数塩基の塩基配列が繰り返されるDNA配列の領域)においてその影響は顕著となり、繰り返しの数のばらつきが高い頻度で生じるマイクロサテライト不安定性(Microsatellite Instability:MSI)の状態が引き起こされ、ミスマッチ修復異常による変異の蓄積はがん関連遺伝子においても起こるため、腫瘍の発生やその進展の要因とまります。
ミスマッチ修復関連遺伝子の生殖細胞系列変異は、大腸癌、胃癌、そして子宮内膜癌を若年で発症する常染色体優性遺伝形式の疾患であるLynch症候群との関連が有名です。

In addition to pathogenic variants in the above-mentioned genes (which lead to a moderate-to-high lifetime risk of pancreatic cancer), large-scale population-based genome-wide association studies (GWAS) have identified common variants in several genomic regions as significantly associated with pancreatic cancer risk.
In European ancestry populations, associated regions include 1q32.1 (NR5A2), 1p36.33 (NOC2L), 2p13.3 (ETAA1), 3q29 (TP63), 5p15.33 (CLPTM1L, TERT), 7p14.1 (INHBA), 8q21.11 (HNF4G) 8q24.21 (MYC), 9q34.2 (ABO), 13q12.2 (PDX1), 13q22.1 (KLF5), 16q23.1 (BCAR1), 17q12 (HNF1B), 17q25.1 (LINC00673), 18q21.32 (GRP) and 22q12.1 (ZNRF).
GWAS have been conducted both in Chinese and Japanese populations, with five loci (21q21.3, 5p13.1, 21q22.3, 22q13.32 and 10q26.11) found to be associated with pancreatic cancer in the Chinese population, and six loci (6p25.3, 12p11.21, 7q36.2, 13q12.2, 13q221 and 16p12.3) found in the Japanese population.
Many of the loci are distinct and have not been replicated across ancestral populations.
However, a GWAS in the Japanese population found evidence of replication (P < 0.01) for 1q36.33, 9q24.2, 13.q12.2, 17q24.2 and 13q22.1 (REF.), which are loci first reported to be associated with pancreatic cancer in European populations
Individually, these variants have only a small effect on pancreatic cancer risk but each additional copy of a risk allele is associated with a 10–30% increase in the risk of pancreatic cancer95. The effects of these common variants are similar in patients with pancreatic cancer with a family history of pancreatic cancer.
In addition, secondary analyses of GWAS data, focusing on pathway-based associations or transcriptome-wide associations, have suggested several other candidate regions requiring further replication and follow-up、
Studies are underway to fully understand the mechanisms underlying both the primary and secondary associations and to increase the diversity of genomic studies of pancreatic cancer.
2024年6月16日 | カテゴリー:胆管膵疾患 |





