GLP-1は脂肪肝に有効
GLP-1によって脂肪肝が改善する
The glucagon‐like peptide‐1 receptor agonist semaglutide has shown a significantly higher percentage of patients with NASH resolution (and no worsening of fibrosis) compared to placebo in a 72‐week, double‐blind phase 2 trial involving 320 patients with biopsy‐confirmed NASH and fibrosis stage 1–340. Improvement in fibrosis stage was seen in 43% of NASH patients and 33% of placebo patients, but this difference was not statistically significant [40]. Importantly, around 38% of patients in the study had no (!) diabetes mellitus, however all had at least a BMI >25. Also of note, the semaglutide dosage used (0.1, 0.2 or 0.4 mg once‐daily) was significantly higher than in its main indication (treatment of diabetes mellitus type II). A previous study investigating the efficacy of the GLP‐1 agonist liraglutide in 52 overweight patients with clinical evidence of NASH showed a significantly higher rate of NASH resolution in the liraglutide group compared to placebo [41]. Most importantly, 9% in the liraglutide group versus 36% in the placebo (p = 0.04) group showed a progression of fibrosis [41]. A recent meta‐analysis consisting of 11 RCTs that investigated GLP‐1 agonists in NAFLD patients concluded that their overall clinical effect lies mainly in NASH resolution rather than fibrosis improvement [42].
Current treatment of non‐alcoholic fatty liver disease

GLP-1 contributes to increases in PGC-1α expression by downregulating miR-23a to reduce apoptosis
PMID: 26315270
GLP-1 can help to overcome problems of liver cells metabolism, not only pancreatic cell. But the explicit mechanism of this effect remains unclear. In recent years, microRNAs have received the attention of researchers and some microRNAs have important implications for diabetes. The mitochondrial protective gene PGC-1α is also closely related to diabetes, and UCP2 is related to anti-mitochondrial oxidative stress, but the mechanism of action of these genes is unclear. In this study, we used HepG2 cell line and used the cell counting kit (CCK) to measure the cell viability with GLP-1(7-36) and/or glucotoxicity. To investigate alterations in gene expression resulting from incubation with GLP-1 (7-36) or hyperglycaemia, the RNA expression levels of miR-23a, PGC-1α, Bak, Bax and UCP2 were quantified using real-time PCR. The protein levels of PGC-1α were determined by western blot. The role of miR-23a in the regulation of PGC-1α was further assessed through cell transfection to downregulate of miR-23a expression. In this study, the viability of HepG2 hepatocytes was decreased under hyperglycaemia, but incubation with 10 nmol/L GLP-1 (7-36) amide for 24 h significantly increased the viability and decreased the mRNA expression levels of Bax and Bak. Incubation with GLP-1(7-36) amide for 24 h attenuated the RNA expression of miR-23a and increased the mRNA and protein expression of PGC-1α. Inhibition of miR-23a expression by cell transfection led to increases in the mRNA and protein expression of PGC-1α. In addition, the mRNA expression of UCP2 increased after incubation with GLP-1(7-36) for 24 h. In conclusion, GLP-1 induced increased expression of mitochondrial protective gene PGC-1α by downregulating miR-23a to inhibit hepatocyte apoptosis and also enhanced UCP2 to reduce apoptosis.
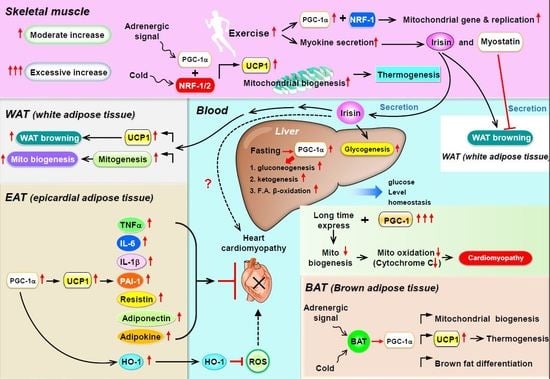
PPARGC1AまたはPGC-1α(peroxisome proliferator-activated receptor gamma coactivator 1-alpha)は、ヒトではPPARGC1A遺伝子にコードされるタンパク質である[4]。PPARGC1Aはhuman accelerated regionと呼ばれる、
PGC-1αは、ミトコンドリア生合成のマスターレギュレーターである[6][7][8]。また、PGC-1αは肝臓における糖新生の主要な調節因子であり、糖新生のための遺伝子発現の増加などを担う[9]。
PGC-1αはエネルギー代謝に関与する遺伝子を調節する転写コアクチベーターであり、ミトコンドリア生合成のマスターレギュレーターである[6][7][8]。このタンパク質は核内受容体のPPARγと相互作用し、それによって複数の転写因子との相互作用が可能となる。また、このタンパク質はCREBや核呼吸因子(nuclear respiratory factor, NRF)とも相互作用し、これらの活性を調節する[10]。PGC-1αは外部の生理的刺激とミトコンドリア生合成の調節を直接関連付ける役割を果たし[10]、また筋繊維のタイプの分化を調節する主要な因子でもあり、遅筋繊維の形成を駆動する[11]。
持久運動はヒトの骨格筋においてPGC-1αの遺伝子を活性化することが示されている[12]。
運動によって骨格筋で誘導されたPGC-1αはオートファジー[13]と小胞体ストレス応答[14]を増大させる。
PGC-1αタンパク質は、血圧の制御、細胞のコレステロール恒常性の調節、そして肥満に関与している可能性がある[10]。
PGC-1αによるSIRT3のアップレギュレーションは、ミトコンドリアをより健全にする[15]。
PGC-1αは外部からのシグナルを統合する主要な因子であると考えられている。PGC-1αは多くの因子によって活性化されることが知られている。
- 絶食は肝臓のPGC-1αなど、糖新生に関与する遺伝子の発現を増加させる[16][17]。
- 低温曝露によって強く誘導され、この環境刺激を適応的熱産生(adaptive thermogenesis)へ関連付ける[18]。
- 持久運動によって誘導される[12]。PGC-1αは乳酸代謝を決定する。持久運動時の乳酸の高レベルの蓄積を防ぎ、乳酸をエネルギー源としてより効率的に利用できるようにする[19]。
- SIRT1はPGC-1αに結合して脱アセチル化によって活性化し、ミトコンドリア生合成に影響を与えることなく糖新生を誘導する[20]。
PGC-1αは上流の調節因子の一部に対してポジティブフィードバックを行うことが示されている。
AktとカルシニューリンはどちらもNF-κB(p65)の活性化因子である[23][24]。PGC-1αはこれらを活性化することでNF-κBを活性化しているようである。筋肉ではPGC-1αの誘導後にNF-κB活性の増大がみられることが示されているが[25]、この発見には議論があり、他のグループはPGC-1がNF-κBの活性を阻害することを示している[26]。
PGC-1αは急性腎障害時にNADの生合成を駆動し、腎臓の保護に大きな役割を果たすことが示されている[27]。
PPARGGC1Aはミトコンドリア代謝に対する保護効果によってパーキンソン病の治療となる可能性が示唆されている[28]。
さらに、PGC-1αの脳特異的アイソフォームはハンチントン病、筋萎縮性側索硬化症など他の神経変性疾患に役割を果たしている可能性が高いことが同定されている[29][30]。
マッサージ治療はPGC-1αの量を増加させ、新たなミトコンドリアの産生をもたらすようである[31][32][33]。
PGC-1αとβは、STAT6の上流の活性化に伴うPPARγとの相互作用によって、抗炎症性M2マクロファージの極性化に関与することが示唆されている。PGC-1のSTAT6/PPARγを介したM2マクロファージ活性化効果は独立した研究でも確認されており、さらにPGC-1が炎症性サイトカインの産生を阻害することも示されている[34]。
PGC-1αは運動中の筋肉から3-アミノイソ酪酸の分泌を担うことが提唱されている[35]。白色脂肪における3-アミノイソ酪酸の効果には、白色脂肪組織の褐色化を促進する熱産生遺伝子の活性化や、その後のバックグラウンド代謝の増加などがある。したがって、3-アミノイソ酪酸はPGC-1αのメッセンジャー分子として作用し、白色脂肪など他の組織でPGC-1α増大の効果がみられることが説明される。
相互作用
PPARGC1Aは次に挙げる因子と相互作用することが示されている。





