小腸と酸化ストレスについて
東京医科歯科大学難治疾患研究所生体防御学の研究チームによると
組織幹細胞は,各組織に存在し,すべての組織構成細胞を供給する能力を持った希少な細胞集団である.同細胞は,一般的に非常にゆっくり細胞分裂をする,またはほとんど細胞分裂をしない長寿命の細胞と考えられてきたが,腸管上皮組織の活発なターンオーバーは,それらとは異なり,長寿命でありながら活発に細胞分裂する,腸管上皮に特有の組織幹細胞(intestinal stem cell:ISC)によって担われている.
哺乳類の腸管上皮組織の活発なターンオーバーは,腸陰窩の最底部に局在するごくわずかな腸管上皮幹細胞(intestinal stem cell:ISC)によって担われている.ISCは細胞自律的に生存しているわけではなく,幹細胞ニッチと呼ばれる特異な微小環境の中で,多様な細胞のサポートを受けることでその性質が保たれている.最近の解析技術の進歩により,これまで知られていなかったISCとそのニッチ細胞の多様性や,損傷上皮再生メカニズムが明らかにされている.
哺乳類の小腸や大腸の表面を覆う,たった1層の上皮細胞層は,食物の消化や,栄養・水分の吸収を行うのみならず,腸内細菌や病原菌などの体内への侵入を防ぐ,第一線のバリアとして機能している.腸管上皮組織は,管腔側に突出し成熟上皮細胞からなる「絨毛」と,粘膜側に陥入し増殖上皮細胞を含む「陰窩」から構成される.生命維持において重要なこの腸管上皮組織を常に健常に保つために,上皮細胞はわずか3~5日ですべて新しいものに置き換わる1).この活発な新陳代謝を可能にしているのが,ISCを起源とする細胞供給システムである.すなわち,陰窩の最も深い部分に局在し,自己複製能と多分化能を持ったわずかなISCが上皮前駆細胞を生み出し,それらが一過的増殖細胞(transit amplifying細胞,TA細胞)として急速に増殖することで,大量の成熟上皮細胞が作られる.上皮前駆細胞には,吸収上皮前駆細胞と分泌上皮前駆細胞があり,前者は上皮細胞の大半を占める吸収上皮細胞に分化し,一方後者は,パネート細胞,内分泌細胞,タフト細胞,杯細胞といった多様な分泌上皮細胞に分化する.陰窩のTA細胞領域で増幅された上皮細胞は,絨毛側へと押し出されるように移動し,陰窩−絨毛の境界部で増殖を停止する.その後,絨毛の先端まで移動した上皮細胞は,管腔側に脱落することで代謝される.一方,成熟パネート細胞はこれらとは逆に陰窩底部へと移動し,そこで2か月もの間生存するといわれている2).
我々の各組織に存在する組織幹細胞は,一般的に非常にゆっくり細胞分裂をする,またはほとんど細胞分裂をしない長寿命の細胞であり,それがゆえに,放射線や抗がん剤の作用に対し抵抗性を示すと考えられてきた.当初,腸管上皮組織でも,陰窩最底部から数えて4番目の上皮細胞の位置に,ほとんど分裂をしない,いわゆる“+4細胞”が見いだされ,これがISCと考えられた3, 4).また,これまでに+4細胞が特徴的に発現するマーカー遺伝子として,Bmi15),Tert6),Hopx7),Lrig18),Krt199),Mex3a10)が同定されており,各々の+4細胞マーカーを発現する上皮細胞の細胞系譜を追跡可能なレポーターマウスを用い,確かにこれらの細胞がすべての種類の腸管上皮細胞を供給する幹細胞性を持つことが確認されている.その一方,腸管上皮組織には,それまで信じられてきた組織幹細胞の特徴とは異なり,長寿命でありながら活発に細胞分裂する幹細胞が存在することが明らかとなった.これらの細胞は,陰窩底部に局在するため腸陰窩基底円柱細胞(crypt base columnar cell:CBC)と呼ばれ,R-spondinに対する受容体であるLgr5を特徴的に高発現している.Lgr5発現細胞の細胞系譜追跡実験から,同細胞がすべての種類の腸管上皮細胞への分化能を持ち,また定常時の腸管上皮組織の活発なターンオーバーを担う主要な上皮幹細胞であることが確認された11).興味深いことに,このLgr5幹細胞特異的にジフテリア毒素受容体(DTR)を発現する遺伝子操作マウス(Lgr5DTRマウス)にジフテリア毒素(DT)を投与し,Lgr5幹細胞を完全に除去しても,再びLgr5幹細胞が再生され,腸管上皮組織の恒常性は正常に保たれることが明らかにされた12).この結果は,上皮組織にはLgr5幹細胞の“リザーブ”としての役割を持つ,Lgr5幹細胞とは異なる幹細胞プールがあることを示唆する.これに関連し,前出の+4幹細胞は,Lgr5幹細胞が失われる場合にそれらを再生する能力があることから,このリザーブ幹細胞の役割を持つと考えられる.したがって,現在の解釈では,ISCには,(1)活発に増殖し腸管上皮の恒常的な供給源となるLgr5幹細胞と,(2)ゆっくりと分裂し,定常時の上皮細胞供給にはあまり寄与しないが,Lgr5幹細胞リザーブとして働く休止期幹細胞(+4幹細胞),の2種類の幹細胞が存在すると考えられている.しかしながら,これら+4幹細胞マーカー遺伝子は,Lgr5幹細胞にも相当度発現することも報告されており,腸管上皮組織に休止期幹細胞という特異な細胞集団が存在するのかについてはいまだに議論が続いている13).
休止期幹細胞は,もともと核酸アナログであるエチニルデオキシウリジン(EdU)やブロモデオキシウリジン(BrdU)を長期に保持する細胞,すなわち“標識保持細胞(label retaining cells:LRCs)”として同定されてきた.同手法では,一過的にすべての細胞の染色体にこれらの核酸アナログを取り込ませた後,増殖細胞では有糸分裂を経てそれらの染色体が薄まっていくのに対し,取り込まれた核酸アナログを染色体に長期間保持する細胞を休止期細胞として同定する.しかしながら,この方法では,EdUやBrdUを検出するために組織や細胞を採取する必要があり,培養下や生体内において,当該細胞の幹細胞としての能力を解析することは不可能であった.この点を克服し,生体内でLRCsの幹細胞性を評価するため,Buczackiらは,核酸アナログを取り込ませる代わりに,薬剤投与によって幹細胞を含むすべての小腸上皮細胞の核に蛍光タンパク質を発現するマウス(Cyp1a1-H2B-YFPトランスジェニックマウス)を利用し,細胞分裂による蛍光の減衰の程度を測ることで,腸管上皮細胞の中のLRCsを可視化した.遺伝子発現解析から,これら細胞はLgr5のみならず,既出の休止期幹細胞マーカーであるTert, Lrig1, Hopxを発現しており,またパネート細胞や上皮内分泌細胞へ分化する分泌系前駆細胞であることがわかった14).
各組織の組織幹細胞の機能や性質は,それらが局在する生体内微小環境(幹細胞ニッチ)から供給される多様な分子(ニッチ因子)によって維持されている15).小腸ISCの場合,たとえば,それらと近接するパネート細胞が,EGFやWnt3,および細胞表面分子であるDll4を発現し,幹細胞の維持に必須のEGFR/Ras/MAPK, Wnt, Notchシグナルを恒常的に供給している16).また,大腸にはReg4遺伝子を特徴的に発現するdeep crypt secretory(DCS)細胞が存在し,小腸パネート細胞と同様にNotchリガンド(Dll1, Dll4)やEGFを発現することで,大腸ISCの維持に関わっている17).一方,分泌上皮細胞分化に必須の転写因子であるAtoh1(Math1)遺伝子18)を腸管上皮細胞特異的かつ薬剤誘導性に欠損するマウス(Math1flox/flox:Vil-CreERT2マウス)では,パネート細胞が陰窩底部から完全に消失するが,その場合にもISCは維持されることから,パネート細胞はニッチ因子の供給源として必須ではないと考えられていた19, 20).
最近の報告において,パネート細胞除去マウスでは,内分泌細胞やタフト細胞がパネート細胞に代わるNotchリガンドの供給源となることが示されている21).WntリガンドはISCの自己複製に必須であるが22),腸管組織ではパネート細胞が分泌するWnt3のみならず,ISC近傍の間葉系細胞からも多様なWntファミリー分子が分泌されており,これらが協調してISCの自己複製維持に関わると考えられる23).さらに,Wntシグナルを促進する作用のあるR-spondinも,これらの間葉系細胞から分泌されている24).実際に,Wntの細胞外分泌に必須の分子であるPorcnを腸管上皮下の間葉系細胞で欠損するマウス(Porcnfl/fl:Pdgfra-Creマウス)では,陰窩が形成されなくなることが確認されており,これらの間葉系幹細胞に由来するWntがISCの維持には必須であることを裏づける25).さらに,Kaestnerらは,このようなニッチ因子を分泌する間葉系細胞として,転写因子であるFoxl1を発現する“Telocyte”と呼ばれる線維芽細胞の亜集団を同定している.同細胞集団は,Wntシグナル誘導に関わる,Wnt2b, Wnt5a, R-spondin3,およびBMP阻害因子(Chordin-like 1, Gremlin1)を恒常的に発現しており,Foxl1発現細胞特異的にPorcnを欠損したマウスでは,小腸上皮および大腸上皮のISCやTA細胞の増殖が著明に低下することを確認した.したがって,同細胞集団はISCの長期維持に必須の細胞であるといえる26).しかしながら,TelocyteはWntシグナルを抑制するBMPも同時に発現していることから26),性質の異なるヘテロな細胞の集合であることが予想される.一方McCarthyらは,単一細胞遺伝子発現解析を用いて腸管組織の間質細胞亜集団をさらに詳細に解析し,Foxl1陽性でPDGFRα(間葉系幹細胞マーカー)を高発現する細胞をTelocyteとして同定し,さらに,これらとは異なる間質細胞集団として,CD81陽性でPDGFRαを低発現する“Trophocytes”を同定した.同報告では,Telocytesが陰窩全体の上皮細胞下の基底膜に沿って局在し,Wnt, R-spondin, BMPを発現する細胞であるのに対し,Trophocytesは,陰窩底部の幹細胞領域近傍に局在しGremlin 1(Grem1)を発現する細胞として特徴づけている.また,Trophocytes(Grem1陽性細胞)をDTRシステムで除去すると,2日以内に腸管上皮幹細胞が著しく減少することが明らかにされていることから,Trophocytesの分泌するGrem1も幹細胞維持に必須であると考えられる27).
既述のとおり,+4幹細胞は腸管上皮損傷時にLgr5幹細胞を再生するリザーブ細胞として,上皮組織の再生に寄与すると考えられるが6, 8–10),これら以外にも腸管上皮の損傷後再生を担う新たな上皮細胞集団が明らかにされている.
ごく最近の報告において,Ayyazらは,マウスの腸管損傷上皮再生の起点となる新たな上皮細胞集団を報告している.彼らは,マウスに放射線照射し3日後の,上皮損傷がまさに生じているタイミングで陰窩上皮を採取し,それらについて単一細胞遺伝子発現解析を行った.クラスター解析により,生き残った細胞集団の特徴づけを行ったところ,損傷時特異的に増幅される細胞集団があることがわかった.これらの細胞集団ではYAPシグナルが活性化しており,マーカー遺伝子としてYAP標的遺伝子の一つであるClusterin(Clu)を発現していた.また,Clu発現細胞は,定常時の陰窩上皮にもわずかに存在するが,生理的な上皮ターンオーバーに関わるLgr5幹細胞とは異なる細胞であった.実際にClu発現細胞の細胞系譜追跡やそれらを生体内から除去する実験により,同細胞が上皮再生に必須であることを明らかにしている28).
一方,幹細胞から分化の進んだ前駆細胞や成熟上皮細胞が,上皮損傷時に幹細胞性へと脱分化するという,興味深い現象が複数のグループから報告されている.たとえば,Dll1やAtoh1を発現する分泌前駆細胞が放射線照射による上皮損傷後にLgr5幹細胞へと脱分化することが示されている29–31).また,前出のとおり,BuczackiらがCyp1a1-H2B-YFPトランスジェニックマウスを用いて同定したLRCsも分泌前駆細胞の特徴を持っている14).さらに,Alpi陽性の吸収上皮前駆細胞32)や,より分化の進んだ成熟上皮細胞であるBmi1陽性内分泌細胞33),Lyz1陽性パネート細胞34, 35),さらにDclk1陽性タフト細胞36)も,上皮損傷後の細胞系譜追跡によりLgr5幹細胞を再生することが示されている.以上の結果から,損傷した腸管上皮組織では,それを速やかに修復するために多様な上皮細胞種が一過的に幹細胞機能を獲得し,協調して上皮再生を促すことが考えられる.これに対し,Metcalfeらは,前出のLgr5DTRマウスにおいて,Lgr5発現細胞を完全に除去すると,放射線照射による上皮損傷後の再生が起こらなくなることを見いだした.この結果は,脱分化などを介してさまざまな細胞が上皮再生に関わる可能性はあるものの,上皮再生に関わる主要な集団は,Lgr5発現細胞に含まれることを示唆する37).
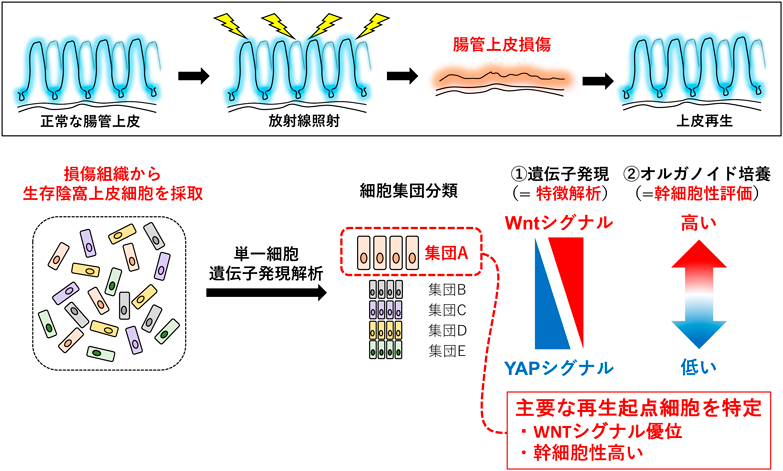
Lgr5-EGFP蛍光レポーターマウス(Lgr5-EGFP-IRES-CreERT2マウス)では,腸管上皮のLgr5幹細胞を,EGFP発現細胞としてフローサイトメーターや蛍光顕微鏡下で検出することができる.さらに,適切なレポーターマウスと交配することで,タモキシフェン投与によりLgr5幹細胞とその子孫細胞でレポーター遺伝子が発現するため,Lgr5幹細胞の細胞系譜追跡が可能である.我々は,Lgr5幹細胞の細胞系譜追跡マウス(Lgr5-EGFP-IRES-CreERT2:Rosa-lsl-tdTomatoマウス,またはLgr5-EGFP-IRES-CreERT2:Rosa-lsl-LacZマウス)を作製し,生理的にもともと存在するLgr5幹細胞が,どの程度放射線照射による損傷後の上皮再生に関わるかを検討した.タモキシフェン投与によって“Lgr5幹細胞のみ”が標識(つまり,蛍光レポーター遺伝子,またはLacZ遺伝子が発現)されるタイミングで放射線照射により上皮を損傷し,2週間後の完全に上皮再生が完了した後に,放射線照射前に存在したLgr5幹細胞の上皮組織再生への寄与度を検討した.その結果,陰窩–絨毛上皮のほとんど,および再生されたLgr5幹細胞の7割以上が,放射線照射前にLgr5幹細胞であった細胞に由来していることがわかった38).この結果は,Lgr5幹細胞が放射線損傷後の上皮再生に必須であるという,前出のMetcalfeらの知見を裏づける結果といえる.次に,放射線照射後に生き残ったLgr5幹細胞(以下,サバイバーLgr5幹細胞と記載)を単一細胞遺伝子発現解析,細胞系譜追跡およびオルガノイド培養を組み合わせて解析することで,上皮再生の起点となる細胞の特徴を解析した.放射線照射後の陰窩上皮では,YAPシグナルが一過的に活性化することはすでに報告されており39),前出のAyyazらの研究によってもYAPシグナルターゲットの一つであるClu遺伝子を発現する細胞が再生に関わる有望な集団であることが示されている28).我々の単一細胞遺伝子発現解析の結果では,個々のサバイバーLgr5幹細胞間ではYAPシグナル標的遺伝子の発現レベルが相当度異なっており,同シグナルの活性化度合いが細胞間できわめて多様であると考えられた.Wntシグナルの活性化は,定常時のLgr5幹細胞の維持のみならず,上皮損傷後の再生にも必須である.したがって,Wnt分泌に必須のPorcnに対する阻害剤をマウスに投与した後に,放射線照射により上皮損傷を起こすと,上皮の再生が著しく阻害されることが報告されている40).このWntシグナルとYAPシグナルは,いうなれば「シーソー」のような関係にあるため39),我々の単一細胞遺伝子発現データにおいても,放射線照射48時間後のサバイバーLgr5幹細胞のなかには,確かにYAP標的遺伝子の発現が相対的に高く,Wntシグナル標的遺伝子の発現が相対的に低い細胞クラスター(Wntlo/Yaphiクラスター)と,これとは逆にYAP標的遺伝子の発現が相対的に低く,Wntシグナル標的遺伝子の発現が相対的に高い細胞クラスター(Wnthi/Yaploクラスター)が存在していた.またこれらの画分を採取精製し,オルガノイド培養系によって各々の幹細胞性を評価すると,Wnthi/Yaploクラスターのオルガノイド形成能,すなわち幹細胞としての能力が,Wntlo/Yaphiクラスターのそれに比べ明らかに高かったことから38),Wntシグナルが優勢のサバイバーLgr5幹細胞が,優先的に上皮損傷後の再生に寄与していると考えられた(図1).重要なことに,Ayyazらが報告した放射線照射後に増幅されるClu発現細胞28)は,我々のサバイバーLgr5幹細胞の中では,より幹細胞性の低いWntlo/Yaphiクラスターの中に含まれていたことから,我々の見いだしたWnthi/YaploクラスターがClu発現細胞よりも上皮再生への寄与度が高いと考えられる.また,放射線照射後の陰窩上皮細胞の多くではYAPシグナルが活性化するため28),その標的遺伝子の一つでるClu遺伝子を標識するAyyazらの細胞系譜追跡では,大半の陰窩上皮細胞が遺伝学的に標識されてしまっている可能性がある.したがって,Clu発現細胞が再生の起点となる上皮細胞画分を含むのは当然のことであり,この報告が特定の再生起点細胞を同定し,それらの上皮再生能を評価しているとはいいがたい.
図1 損傷腸管上皮に含まれる再生起点細胞の同定
放射線照射により損傷した小腸上皮組織から,生き残った陰窩上皮細胞を採取し,単一細胞遺伝子発現解析,オルガノイド培養などを組み合わせて,腸管上皮再生の起点となる主要な細胞集団を特定した.詳細は本文,および文献38参照.
我々は,さらに詳細にサバイバーLgr5幹細胞の細胞表面分子を解析し,Sca1陰性CD81陽性の細胞画分が上皮再生に関わる主要な細胞であることを明らかにした38).また,同細胞画分は,遺伝子発現パターンからClu陽性細胞やこれまでに再生起点細胞候補と考えられてきたDll1陽性分泌上皮前駆細胞,Mex3a陽性休止期幹細胞とは異なる細胞と考えられた38).
最近の研究において,免疫細胞,特にそれらが生産する多様な免疫サイトカインが,ISC機能を調節することが明らかにされている.たとえば,BitonらはLgr5幹細胞の特定のサブセットがMHCIIを高発現していることを見いだし,それらが実際に抗原提示能を持ち,ヘルパーT(Th)細胞を活性化しうることを明らかにした.さらに,さまざまなTh細胞サブセットや,それらが生産するサイトカインの存在下で腸管上皮オルガノイドを培養することで,ISCへのThサイトカインの作用を観察した.その結果,Th2細胞またはそれらが分泌するインターロイキン(IL)-4やIL-13の存在下で培養したオルガノイドでは,ISCが消失することが示された.また,Th1細胞またはそれらが分泌するインターフェロン(IFN)-γ, Th17細胞またはそれらが分泌するIl-17の存在下ではISCが減少し,分化の進んだTA細胞が増加することを見いだしている.一方,制御性T細胞またはそれらが分泌するIL-10は,ISCを増加させることを観察した41).
また,自然リンパ球(innate lymphoid cells:ILCs)も,免疫サイトカインを介してISC機能を制御することが知られている.ILCサブセットの一つであるILC2は,2型免疫反応に関わる自然免疫細胞であり,IL-5, IL-13, IL-25およびIL-33を分泌する.寄生虫感染時には腸管上皮においてタフト細胞が著しく増加することが知られており,それらがIL-25を分泌することでILC2が活性化される.その際,活性化ILC2から分泌されたIL-13が,ISCに直接作用し,杯細胞の分化が促進されることが示されている42–44).杯細胞は,腸管の粘液主成分であるムチンの生産源であることから,このようなタフト細胞–ILC2–ISCの相互作用が,最終的に粘液生産を亢進させ寄生虫の排除につながると考えられる45–47).一方,ILC3はIL-10ファミリーサイトカインの一つであるIL-22を生産する.ILC3から生産されるIL-22はマウスGVHD(移植片対宿主病)モデルで起こる腸管上皮障害の修復に関わっており,そのメカニズムとして,IL-22がLgr5幹細胞に作用し,Stat3の活性化を介して,損傷時のISCの生存と増殖を促進する働きがあることが示されている48).さらにILC3やγδT細胞由来のIL-22は,ISCにおいてDNA損傷応答を促進することで,遺伝毒性ストレスからISCを保護し,がん化を防ぐ働きが想定されている49).このように,免疫系は,ISCの機能を直接制御することで,上皮組織の適応応答において重要な役割を担っている.
I型IFNも,ウイルスに対する防御応答の中心を担う免疫サイトカインである.I型IFNは感染により,免疫細胞のみならず,線維芽細胞などさまざまな細胞から一過的に分泌され,周囲の細胞に作用することで抗ウイルスタンパク質の発現を誘導する.I型IFN遺伝子は,ヒトでは13種類,マウスでは14種類のIFN-α遺伝子と,1種類のIFN-β遺伝子から構成される50).一方,I型IFN受容体は,大部分の細胞に発現しており,I型IFN分子が細胞表面のIFN受容体サブユニット2に結合すると,IFN受容体サブユニット1との複合体が形成される.これにより,各々の受容体の細胞内領域に会合しているTyk2, Jak2が活性化される.さらにこれらにより,STAT1, STAT2のチロシン残基がリン酸化され,STAT1, STAT2およびIFN制御因子9(IRF9)のヘテロ三量体からなる転写因子複合体,ISGF3が形成される.ISGF3転写活性化複合体は,核内に移行し,特定のゲノム配列(interferon stimulated response element:ISRE)に結合することで,抗ウイルスタンパク質遺伝子をはじめとする1000種類ものIFN誘導遺伝子(ISG)の発現を誘導する51–53)(図2A).
一方,IFN制御因子の一つであるIRF2(interferon regulatory factor-2)は核内に存在し,ISGF3と競合的にISREに結合することでISGの発現が過剰にならないように制御する働きがある.したがって,IRF2を欠損するマウス(Irf2−/−マウス)では,さまざまな臓器や組織でISG発現が定常的に亢進してしまう54)(図2B).
既述のとおり,I型IFNはウイルス感染時に生産され,ウイルス排除に中心的な役割を担うが,興味深いことにウイルス感染がない生体内や培養細胞でも,ごく微量ながら分泌されていることが知られている55, 56)(図2A).実は,この微弱であるが恒常的なI型IFNシグナルの活性化は,宿主の抗ウイルス応答時に重要な意義を持つことが明らかにされている.IRFファミリー分子である,IRF3およびIRF7は,ウイルス感染時のI型IFN生産に必須の転写因子である.IRF3は恒常的にタンパク質レベルで細胞質に分布するが,IRF7はI型IFNの作用時のみ発現誘導され,タンパク質も速やかに分解される.微弱なI型IFNシグナルは,特にこのIrf7遺伝子発現を恒常的に誘導し,非感染時にも同分子を細胞質にタンパク質レベルで“準備”させる働きがある.これにより実際に感染が起こる際に速やかに十分量のI型IFNを生産することを可能にしている57, 58).この非感染性のI型IFN発現を誘導するトリガーはいまだ十分に明らかではないが,その候補の一つとして,腸内細菌由来成分があげられる.小腸の常在細菌である乳酸菌は二本鎖RNAを豊富に含み,これらが腸管粘膜の樹状細胞からのIFN生産を誘導していることが明らかにされている59).
これまでに,既述のIrf2−/−マウスにおいて,血液の元になる造血幹細胞が著しく減少することを見いだされている.造血幹細胞は,細胞周期を休止期に保つことで,その数や幹細胞としてのポテンシャルを維持しているが,Irf2−/−マウスの同細胞では,非感染性IFNシグナルの慢性亢進により,細胞周期が亢進し,幹細胞性が保てずに分化が進んでいることが判明した60).そこで,我々は他の組織幹細胞でも,幹細胞性を保つために同様のシステムが機能しているかを確認するため,Irf2−/−マウスのISCの解析に取り組んできた61).まず,野生型マウスの小腸上皮組織におけるIrf2遺伝子発現をin situハイブリダイゼーションにより確認し,陰窩および絨毛のすべての腸管上皮細胞で当該遺伝子が発現していることを確認した.予想されたとおり,Irf2−/−マウスの陰窩上皮細胞では,代表的なISG発現がコントロールマウスに比べ著しく亢進していたが,定常状態の絨毛−陰窩の上皮組織構築は正常に保たれていた.また,ISCの細胞系譜を追跡可能なIrf2−/−マウスを作製し,定常時のISCからの上皮細胞供給を観察したが,コントロールマウスの上皮細胞供給との違いは認められなかった.一方,Irf2−/−マウスでは,定常時においてLgr5幹細胞が有意に減少していることを見いだした.したがって,Irf2−/−マウスではISCが相当度減少するものの,定常時の上皮供給はそれらの限られた幹細胞によって十分に保たれていると考えられた.
Lgr5DTRマウスにDTを投与しLgr5幹細胞を完全に除去すると,腸管上皮損傷後の再生が起こらなくなることから37),Lgr5幹細胞が減少するIrf2−/−マウスでは,上皮損傷後の再生能が低下している可能性が考えられた.そこで,Irf2−/−マウスおよびコントロールマウスに,陰窩上皮損傷を誘導することが知られている5-フルオロウラシル(5-FU)を投与し,その後の上皮再生を観察した.その結果,コントロールマウスでは,5-FUによる損傷誘導から6日後には陰窩上皮が完全に再生していたが,Irf2−/−マウスでは,陰窩上皮の再生がほとんど起こらなかった.さらに我々は腸管上皮特異的にIrf2遺伝子を欠損するマウス(Irf2fl/fl:Vil-Cre,以降Irf2ΔIECと記載)を独自に作製し,同様に上皮の再生について観察したが,これらのマウスでも陰窩上皮の再生は著しく低下していた.以上の結果から,腸管上皮に発現するIRF2は,上皮再生に必須であることがわかった.
このような再生不全が,実際にLgr5幹細胞の機能低下に起因するかを検討するため,Irf2−/−マウスからLgr5幹細胞を採取・精製し,3次元オルガノイド培養によりそれらの幹細胞ポテンシャルを検証した.その結果,予想されたとおり,Irf2−/−マウスのLgr5幹細胞は,ほとんどオルガノイドを形成することができなかった.よって,Irf2−/−マウスまたはIrf2ΔIECでは,Lgr5幹細胞の著しい機能低下が生じていると考えられた.同様の幹細胞機能低下は,野生型マウスに対し,IFN生産を誘導するpoly(I:C)を長期間,低容量で投与した場合や,慢性ウイルス感染を起こした場合にも観察されたことから,慢性的なIFNシグナルの亢進により小腸Lgr5幹細胞の機能低下が生じることが示された.さらに,最近我々は,小腸のISCのみならず大腸のISCにおいても,幹細胞機能の維持にIRF2が必要であることを明らかにした62).Irf2ΔIECマウスでは,デキストラン硫酸ナトリウムを投与することで誘導される大腸上皮損傷がほとんど治癒しない.また,大腸陰窩上皮細胞のオルガノイド形成能も相当度低下していることがわかった62).
IFNシグナルの持続がISCにどのような性状変化を引き起こすのかを解析された.前出の,長期間,低容量のpoly(I:C)を,それぞれ正常マウスおよびIFN受容体欠損マウスに投与した後,Lgr5幹細胞を採取し,網羅的遺伝子発現解析を実施した.その結果,正常マウスの幹細胞,すなわちIFNの作用を受けた幹細胞では,IFN受容体欠損マウスの幹細胞,すなわちIFNの作用を受けなかった幹細胞に比べ,ISCに特徴的な遺伝子群の発現が有意に低いことがわかった.その一方,ISCから分化の進んだ上皮前駆細胞に特徴的な遺伝子群の発現は有意に高かった.機能的にも,IFNの作用を受けた幹細胞では,幹細胞性の指標となるオルガノイド形成能が低下していた.一方,IFN受容体欠損マウスの幹細胞では,poly(I:C)投与後にもこのような幹細胞機能低下は認められなかった.以上の結果は,IFNの作用を持続的に受けた幹細胞が,幹細胞の特性を失い,前駆細胞様に分化している可能性を示唆する.さらに興味深いことに,IFNの作用を持続的に受けた幹細胞において発現の高い遺伝子には,分泌上皮細胞が発現する遺伝子が多数含まれており,これらの細胞が幹細胞から分泌系列の細胞へと分化しつつあることが予想された.同様のLgr5幹細胞における分泌上皮細胞遺伝子の発現亢進は,腸管上皮細胞特異的かつ薬剤誘導性にIrf2遺伝子を除去したマウス(Irf2fl/fl:Ah-Creトランスジェニックマウス)でも認められた.この結果を反映し,Irf2−/−マウスでは小腸陰窩底部に未分化なパネート細胞の著明な集積が認められた.以上の結果から,IFNシグナル亢進の持続は,ISCに分泌上皮細胞系列への異常分化を誘導し,これにより幹細胞性が低下していると考えられた
上皮組織損傷時にはさまざまな未熟,成熟上皮細胞が脱分化することで幹細胞性を再獲得する現象が観察されている.これら腸管上皮細胞の驚異的な可塑性は,研究対象としてきわめて魅力的であるが,一方,Lgr5発現細胞を完全に除去すると放射線照射による腸管上皮組織の再生が起こらなくなる,というMetcalfeらの報告37)や,我々の検討結果から考えれば,主要な上皮再生の起点細胞はやはりLgr5発現細胞に含まれると考えられる.この点に関しては,今後,損傷ストレスの違いやその強度の違いによって,異なる再生起点細胞が生じるか検証される必要がある.たとえば,現在用いられる主な腸管上皮再生モデルには,Lgr5DTRマウスにDTを投与することでLgr5幹細胞を除去するモデル,放射線照射モデル,DSS投与モデル(大腸上皮損傷)があるが,これらの間では,上皮再生を誘導するメカニズムが異なる可能性がある.
一方,既述のとおり,最近の研究において,ISCの維持に必須かつ性質や機能の異なる多様な間質細胞亜集団が同定されている.しかしながら,これらの細胞の生態については多くの点が未解明である.たとえば,各々の亜集団が共通の前駆細胞に由来するのか,それらの細胞系譜は不明である.また仮に共通の前駆細胞があるのであれば,各々の亜集団が,腸粘膜という限られた微小環境の中でいかにして異なる性質を獲得するのか,興味が保たれる.さらに,上皮組織損傷時に,各々の間質細胞の性質がどのように変容し上皮再生に関わるのか,検討が必要であろう.これらの点を明らかにすることは,将来的に,炎症性疾患の有効な治療法の開発につながる可能性がある.
生理的に生じる微弱なIFNシグナルが,組織幹細胞の幹細胞性を低下させるストレス要因であることをこれまでに明らかにされてきた.ISCや造血幹細胞は,IRF2というたった一つの分子に働きにより,この生理的IFNストレスを回避し,頑強な腸管上皮や造血系を維持している.このような生理的に生じる組織幹細胞ストレス,およびそれを回避するメカニズムは現在までほとんどわかっていない.たとえば,前出のILC3やγδT細胞が生産するIL-22がISCのDNA損傷応答を誘導する現象は,組織幹細胞の生体内ストレス回避機構の一つと考えられる.組織幹細胞が個体の生涯にわたり維持されるメカニズムを知る上で,この生体内ストレス回避機構を明らかにすることは今後重要である.