心房細動について
心房細動(Atrial Fibrillation, AF)は、心臓の上部にある心房が不規則に震えることで、心臓全体のリズムが乱れる不整脈の一種です。これにより、血液が効率よく全身に送られなくなり、さまざまな症状や合併症を引き起こす可能性があります。
主な症状
動悸(ドキドキ感)
息切れ
めまい
疲れやすさ
胸の痛みや圧迫感
原因
心房細動の原因は多岐にわたりますが、以下のような要因が関与しています:
加齢
高血圧
心臓病(心筋梗塞、心不全など)
糖尿病
肥満
睡眠時無呼吸症候群
甲状腺機能亢進症
診断と検査
心房細動の診断には、以下のような検査が行われます:
心電図(ECG)
ホルター心電図(24時間心電図)
心エコー検査
血液検査
治療法
治療法は症状の重さや原因によって異なりますが、一般的には以下の方法が用いられます:
薬物療法(抗不整脈薬、抗凝固薬など)
カテーテルアブレーション(不整脈の原因となる部分を焼灼する手術)
ペースメーカーの埋め込み
生活習慣の改善(禁煙、適度な運動、健康的な食事など)
心房細動は、適切な治療と管理によって症状をコントロールし、合併症のリスクを減らすことが可能です。心房細動が疑われる場合は、早めに医療機関を受診することが重要です。
肺静脈隔離術(Pulmonary Vein Isolation, PVI)は、心房細動(Atrial Fibrillation, AFib)を治療するための手術です。心房細動は、心臓の上部にある心房が不規則に震えることで、心臓全体のリズムが乱れる不整脈の一種です。
PVIの概要
PVIは、心臓の左心房と肺静脈の接続部周辺に小さな瘢痕を作ることで、異常な電気信号を遮断し、心房細動を防ぐ手術です。この手術は、カテーテルアブレーションと呼ばれる方法を用いて行われ、カテーテルを血管を通じて心臓に挿入し、熱や冷却エネルギーを使用して瘢痕を作ります。
手術の適応
PVIは、以下のような患者に適しています:
抗不整脈薬が効果を示さない場合
抗不整脈薬に対する副作用が強い場合
他の治療法が効果を示さない場合
手術のリスクと合併症
PVIにはいくつかのリスクと合併症があります:
カテーテル挿入部位の出血や感染
血管や心臓弁の損傷
新たな不整脈の発生
血栓の形成による脳卒中や心臓発作
食道の損傷
手術の準備と経過
手術前には、心臓の健康状態を評価するためのいくつかの検査が行われます。手術は病院で行われ、患者は局所麻酔や全身麻酔を受けることがあります。手術後は、数日間の入院が必要となることがあります
Framingham study(フレイミングハム研究。アメリカ、マサチューセッツ州フレイミングハムでの心血管疾患に関する疫学研究)によると、心房細動は発症直後は数ヶ月間の死亡率は高いが、その後、死亡率の傾きは洞調律の患者と変わらないとされている。このデータは診断時に心不全や脳梗塞の既往がある患者を含んでいるため、このデータはすべての心房細動の患者で急性期で予後が悪いという意味を示さない。
心筋梗塞、脳梗塞の既往がなければまずは落ち着いて対処できる疾患であることを物語っている。心房細動の患者の長期予後は心房細動の病型などよりも心臓病、高血圧、糖尿病、甲状腺機能亢進症といったものに規定されている。生活習慣病のコントロールが不十分ならば、抗凝固療法などをおこなってもあまり生命予後は変わらないとされている。
脳梗塞の予防という観点ではCHADS2スコアというものがよく知られている。
CはCongestive Heart Failure(心不全)、
HはHypertension(高血圧症)、
AはAdvanced Age>75(75歳以上の高齢者)、
DはDiabetes Mellitus(糖尿病)、
SはHistory of Stroke(脳梗塞、一過性脳虚血発作の既往)とされている。
C,H,A,Dは該当すれば1点、Sは該当すれば2点でスコアリングする。2点以上ならば脳梗塞の予防となる治療が必要と考えられている(逆を言えば、若年者でリスクがない孤発性の心房細動ならば抗凝固療法は不要である)。ただし前述の通り、収縮期血圧が140mmHgを超える、場合は抗凝固療法を行っても予後の改善効果は乏しいこと、また日本循環器学会のガイドラインと照合するとCHADS2で1点でも抗凝固療法の適応となることもあり異論も多い。初発の心房細動の場合は50%位の確率で生活習慣病の治療の過程で自然消失し、原因がアルコールによる脱水や睡眠不足、ストレスとなることも多い。あくまでも、治療の順序としては、まずは背景因子の治療、抗凝固療法、最後に心房細動自体の治療と考えるとわかりやすい。
原因
心房筋の機能的、組織学的な変化により興奮伝導のばらつきが生じ、これが伝播方向の異なる複数の興奮波を形成し、それぞれの興奮波はリエントリーと呼ばれる旋回を示しながら興奮間隙を縫うように心房を連続的に興奮させ、心房細動を発生させると考えられている(スパイラルリエントリー)。基礎疾患のない患者の90%以上は肺静脈の期外収縮がトリガーとなっており、カテーテルアブレーションによって治療が可能となっている。逆に心房細動を起こす基礎疾患には心房負荷を起こす疾患(僧帽弁狭窄症、僧帽弁閉鎖不全症、心房中隔欠損症)、甲状腺機能亢進症、虚血性心疾患、心筋症、WPW症候群等がある。
症状
心室から送り出される血液の体積が減って心臓の効率が低下するだけでなく、心房の中の血液がよどみ、血栓ができやすくなる。心房細動は、めまいや動悸、疲れやすさだけでなく、心不全への移行や心原性の脳梗塞(特に脳塞栓症)と心筋梗塞の原因となりがちである。特に脳梗塞は比較的大きな血管を詰まらせることで重症化しやすい。老人に多い。
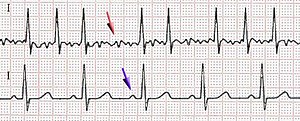
心電図検査では以下の所見が認められる。
- RR間隔の不整
- 心拍が周期性を失うのでRR間隔(あるR波から次のR波までの間隔、すなわち一拍ごとの時間)が不規則になる。絶対性不整脈と呼ばれるのはこのためである。
- P波消失
- 心房の活動が分散するため、心房の電位変化を示すP波が消失する。
- f波出現
- f波は基線の動揺の事。分散した心房の活動がf波として記録される。V1誘導で見つけやすい。
f波の振幅が大きいほどカルディオバージョンされやすいとされている。抗不整脈薬を投与するとf波の振幅が大きくなることがありこのような場合もカルディオバージョンされやすい。右脚ブロック型の変行伝導が認められることもある。
心臓超音波検査心臓超音波検査でわかることは心臓の動き(心機能)、心臓の大きさ(心拡大)、基礎疾患の有無、血栓の有無である。そのため心不全の可能性が考えられる場合、起始心疾患が疑われる場合、血栓症の既往がある場合は心臓超音波検査が必要となる。
血流が停滞しずり応力が低下すると赤血球が凝集しもやもやエコーが認められる。これは左房内血栓や血栓塞栓症の危険因子となる。左房径は心房のリモデリングを反映し5mm増加するごとに心房細動の危険率が48%増加するといわれている。また左房径が5cm以上ある場合はカルディオバージョンに成功したとしても再発のリスクが高い。
血液検査
心房細動があるだけでBNPは30〜120pg/mlの増加が認められる。
分類
有名な分類としては発作性心房細動、持続性心房細動、永続性心房細動(慢性心房細動)というものが知られている。
| 分類 | 定義 |
|---|---|
| 発作性心房細動 | 7日以内に自然停止する |
| 持続性心房細動 | 7日以内に自然停止しない |
| 慢性心房細動 | カルディオバージョンされず半年以上に持続 |
発作性心房細動の場合は初回であるか再発性心房細動の区別が重要となる。初回発作のみであれば2回目以降の発作が生じない患者が約半数おり、このような場合は抗凝固療法は不要となる。J-RHYTHM試験では慢性心房細動はリズムコントロールを行っても3年後の洞調律維持は10%程度であることから、胸部症状のある発作性心房細動ではリズムコントロール、持続性心房細動はレートコントロールが推奨されている。
また交感神経依存型心房細動と迷走神経依存型心房細動という分類もある。これは治療薬の選択に重要である。
| 交感神経依存型 | 迷走神経依存型 | |
|---|---|---|
| 好発年齢 | なし | 40〜50歳に初発 |
| 性差 | なし | 男性>女性 |
| 基礎心疾患 | あり | なし |
| 発作の好発時間と誘因 | 日中、特に午前中に多く、運動や精神的ストレスが誘因となる | 夜間に多く、安静、食後、飲酒後が誘因となる |
| 抗不整脈薬の効果 | Βブロッカーが有効である。その他Β遮断作用があるプロパフェノン、アプリンジンが有効である | 抗コリン作用(ムスカリン受容体遮断作用)があるジソピラミド(リスモダン®)、シベンゾリン(シベノール®)、ピルメノール(ピメノール®)が有効である。ジギタリスやΒブロッカーは無効である |
孤立性心房細動
1954年にEvansやSwannらによって提唱された概念である。明らかな基礎疾患なく発症した心房細動を意味していた。しかしその概念は検査法の進歩によって変わってきた。臨床所見、心臓超音波検査、心肺疾患(たとえば肥大心、心不全、虚血心など)ならびに甲状腺疾患、高血圧などがないものとされている。予後良好とされているが60歳を超えると脳血管障害の頻度が増加する。そのため60歳以降は孤立性心房細動に含めないという意見もある。研究者によって定義が異なる。日本の心房細動治療(薬物)ガイドライン2013年改訂版では孤立性心房細動という用語は用いられなくなった。
弁膜症性心房細動と非弁膜症性心房細動
弁膜症心房細動ではリウマチ性僧帽弁疾患(おもに狭窄症)、人工弁(機械弁、生体弁)置換術後をしめす。生体弁は血栓形成の観点からは機械弁に比べて有利であるが、生体弁置換例が心房細動を合併した場合には塞栓症のリスクが高まるため抗凝固療法の適応となる。なお僧帽弁修復術(僧帽弁輪縫縮術や僧帽弁形成術)術後は塞栓症の高リスクとはいえず、非弁膜症性として扱うのが適切と考えられている。またリウマチ性ではない僧帽弁閉鎖不全症は非弁膜症性として扱う。
治療
本症の治療目的には以下の3つがある。
- レートコントロール
- 心房細動のまま、脈拍数のみを整える事。
- リズムコントロール
- 洞調律に戻して維持する事。
- 血栓症・塞栓症の予防
Affirm studyの結果、レートコントロールと抗凝固療法を行った場合とリズムコントロールを行った場合ではレートコントロールと抗凝固療法を行った場合の方が予後がよいことが明らかになった。症状がない心房細動の場合は、来院時の心電図検査とホルター心電図以外に心房細動があるのかを診断する方法がなく、治療が不完全になる可能性が高いということが示唆された。抗凝固療法ではなく抗血小板療法でもアスピリンを300mg程度の高用量で用いれば脳梗塞のリスクを20%ほど軽減できるという報告もあるが、日本循環器学会のガイドラインでは高齢者でも抗凝固療法の施行を推奨している。ワルファリンを適切にコントロールすれば最終的な予後が改善するが、ワルファリンの開始、維持は患者の治療に対する意欲がないと難しい。頻回の採血によるモニタリング、投与量の調節、納豆・クロレラなど食事由来ビタミンKの禁止、他の薬剤との相互作用、外科的処置を行う場合の休薬、不十分な管理での出血でのリスクを考慮すると治療の意欲が乏しい段階では実行は難しい。抗凝固療法は成功すれば約90%の脳梗塞防止効果があるがワルファリンの導入を急ぐあまり、他の生活習慣病の治療が不十分になると最終的予後は悪化するため難しいところである。
ワルファリンの導入は一日2mg(高齢者であれば1.5mg)位から行うのが無難とされている。2週間後のPT-INRで1.5mg未満であれば1mg増量、1.5〜1.6の間であれば0.5mg増量し2週間後再検という操作を繰り返すことが多い。5mg以内で1.6〜2.6のPT-INRで安定することが多い。その後はPT-INRが2.6以上ならば0.5mg減量、2回連続で1.6を下回れば0.5mg増量するといった微調整を行う。高齢者の場合、食欲不振などでコントロールが乱れることも多い。
経口選択的凝固因子拮抗薬であるダビガトランやリバーロキサバンは食事の影響を受けず、APTT測定もほとんど必要ない。日本では、2011年3月にダビガトラン(プラザキサ)が薬価基準に収載された[1] ことなどを受け、日本不整脈学会から心房細動の薬物療法についての声明が出された[2]。これにより、ダビガトランによる抗凝固療法を行うことも増えている。
薬物療法
発作時のレスキューや平常時のコントロールには対症療法として化学物質を用いた薬物療法を行う。まずはレートコントロール(心拍数制御)を行う目的でベラパミルやジルチアゼム、メトプロロール、カルベジロール、ジギタリスを用いる。ジルチアゼムの有用性を指摘する報告もある[3]。またジゴキシンによる心房細動治療において、全死因死亡・心血管死亡・突然死の危険性増加を示唆する報告もある[4]。
それで上手くいかなければリズムコントロールを行う目的でIa群の抗不整脈薬であるジソピラミドやプロカインアミドやキニジンを用いる。副作用が問題になることが多い。ただしWPW症候群を合併している場合はベラパミルやジギタリスの使用は禁忌である。
その他特殊な心房細動
- 徐脈頻脈症候群
- 洞不全症候群に発作性心房細動、心房粗動、心房頻拍、発作性上室性頻拍が合併したものである。頻脈性不整脈に対して抗不整脈薬を投与すると徐脈が重篤化する恐れがある。そのため治療を円滑に行うために心臓ペースメーカーの導入を行うこともある。
- 偽性心室頻拍
- WPW症候群に合併する心房細動であり若年者にも認められる。RR不整を伴う心室頻拍のような心電図所見が特徴的である。非常に有名だがジギタリスやワソラン®は副伝導路の伝導性が高まり血行動態の破綻や心室細動に移行することがある。治療は副伝導路を抑制する抗不整脈薬でありI群の薬物である。サンリズム®50mgやタンボコール®50mgを5分以上かけて静注する、心房細動は停止しないことが多いが、δ波が消失し心拍数も110bpm以下になり自覚症状が改善することが多い。根治的にはカテーテルアブレーションが必要であるため、後日専門医の受診を勧める。
治療に用いる薬物
カテーテル治療
原発性心房細動の根本治療としてカテーテルアブレーション治療が広く行われてきている。
1998年にフランスのボルドー第3大学のMichel HaïssaguerreとPierre Jaïsらによってはじめられた方法で[6]、心臓カテーテル検査を施行し、心房と肺静脈の電気的な回路を焼灼することで隔離する治療法。低侵襲な根治術として現在世界中で広く行われている。
2次性心房細動に対しては要因となる基礎疾患の治療が優先される。
手術治療
一般にMaze手術として知られている。カテーテル治療が行われるまでは唯一の根本治療法であった。心臓の手術は侵襲が大きく、現在ではMaze手術単体のみで施行されることは少なくなり、他の疾患での開胸心臓手術の際に同時に行われることが多い。
Maze手術は、1991年にアメリカのワシントン大学の心臓血管外科医ジム・コックスによって開発されており、その後この手術を元として様々な術式が開発されたが、一般的にMaze手術と総称される。
現在、胸腔鏡補助小開胸下肺静脈隔離術(WOLF法)や完全胸腔鏡下肺静脈隔離術(WOLF-OTSUKA法)など低侵襲手術も実用化されている。
This review focusses on novel findings in atrial fibrillation mechanisms derived from mapping studies. Recent panoramic mapping techniques have identified 2 arrhythmic mechanisms of interest, namely, rotational (rotors) and ectopic focal activations as drivers of atrial fibrillation. Epicardial adipose tissue and fatty infiltration into the myocardium have been described as novel substrates for atrial fibrillation. There is increasing appreciation that the thin atrial walls harbor a complex 3-dimensional electrostructural substrate to contribute to atrial fibrillation sustenance. Further research is warranted to advance the field toward more targeted therapy.
Background: Native T1 mapping has emerged as a noninvasive non-contrast magnetic resonance imaging (MRI) method to assess for diffuse myocardial fibrosis. However, LV native T1 time in AF patients and its clinical relevance are unclear.
Methods: Fifty paroxysmal AF patients referred for PVI (60 ± 8 years, 37 male) and 11 healthy control subjects (57 ± 8 years, 10 male) were studied. All patients were in sinus rhythm during the MRI scan. Native T1 mapping images were acquired using a Modified Look-Locker imaging (MOLLI) sequence in 3 short-axis planes (basal, mid and apical slices) using an electrocardiogram triggered single-shot acquisition with a balanced steady-state free precession readout. Late gadolinium enhanced (LGE) MRI was acquired to evaluate for LV myocardial scar.
Results: LV ejection fraction was similar between groups (AF: 61 ± 6%; controls: 60 ± 6%, p=0.75). No LV myocardial scar was observed in any patient on LGE. Myocardial native T1 time was greater in AF patients (1099 ± 52 vs 1042 ± 20 msec, p<0.001). During a median follow-up period of 326 days, 18 of 50 (36%) patients experienced recurrence of AF. Multivariate Cox proportional hazard analysis identified elevated native T1 time as an independent predictor of recurrence of AF (HR: 6.53, 95% CI: 1.25-34.3, p=0.026).
Conclusions: There are differences in the native LV myocardial T1 time between AF patients with preserved LV function referred for PVI and normal controls. Native T1 time is an independent predictor of recurrence of AF after PVI in patients with paroxysmal AF.
Int.j.cardiol 2016 jan 15 203, 848~854

2024年11月21日 | カテゴリー:循環器 |





