微小管について
微小管(びしょうかん、 microtubule、マイクロチューブル)は、細胞中に見いだされる直径約 25 nm の管状の構造であり、主にチューブリンと呼ばれるタンパク質からなる。細胞骨格の一種。細胞分裂の際に形成される分裂装置(星状体・紡錘体・染色体をまとめてこう呼ぶ。星状体・紡錘体は中心体・微小管複合体そのものをその形態からこう呼んだ)の主体は、この微小管である。
微小管の構造

チューブリンにはα, β, γ, δなどの種類があることが知られているが、微小管は主に、αチューブリンとβチューブリンが結合したヘテロ二量体(ヘテロダイマー)を基本単位として構成される。
α, βチューブリンからなるヘテロ二量体が繊維状につながったものをプロトフィラメントと呼び、これが螺旋の形で11-16本程度集まって管状の構造を取ったものが微小管である。細胞中に見いだされる微小管の主なものは13本のプロトフィラメントからなり、直径が約25nmである。また、鞭毛・繊毛にはダブレット、トリプレットと呼ばれる2本または3本の微小管が融合した構造も見いだされる。
細胞中の微小管の表面には微小管結合タンパク質 (MAPs) と呼ばれるタンパク質が結合している。MAP2が有名。
これらの結合タンパク質の種類は神経細胞、鞭毛、繊毛、紡錘体など、組織や微小管の機能によって異なっており、微小管の機能を調節していると考えられている。チューブリンとこの微小管結合タンパク質の複合体を広義には微小管と呼ぶ。
微小管の伸長
微小管には方向性があり、チューブリン二量体が付加しやすい側を+(プラス)端、解離しやすい側を-(マイナス)端と呼ぶ(微小管はチューブリンの付加により伸長し、解離により短縮される)。+端と-端では付加の速度が二倍程度違う。付加・解離の速度は遊離チューブリンの濃度によって決まり、高濃度の場合はいずれの端でも付加が起こる。濃度の低下とともにまず-端での付加が止まり、低濃度ではいずれの端でも解離が進む。伸長と解離の速度が等しく、全体に平衡状態となる濃度を臨界濃度と呼ぶ。微小管の見かけ上の長さが変化しない場合でも、常に+端での伸長と-端での短縮が起こっており、この状態をトレッドミルと呼ぶ。なお微小管+端においても臨界濃度以上の遊離チューブリンが存在していれば必ずしも伸長が続くというわけではなく、重合を続けていた微小管が突如 急激な脱重合 (catastroph) を起こすことがあり、これを動的不安定性 (dynamic instability) と呼んでいる。
この微小管の伸長と短縮(微小管のダイナミクスとも呼ばれる)は、微小管結合タンパク質 (MAPs) によって様々に変化する。微小管を安定化するもの、微小管を切断するもの、微小管同士を結合するものなどがある。
微小管は、その-端を中心体に置き、重合の場である+端を細胞内の様々な領域に伸ばすことが多い。なお、中心体を構成する中心子自体、9対の三連微小管が環状に配置したものである。また、中心体にはγチューブリンが含まれ、このγチューブリンに結合する形で微小管が伸長する。
微小管とモータータンパク質
細胞分裂の際に形成される紡錘体 (spindle) や、繊毛や鞭毛の主要な構造は複数の微小管の束からなり、染色体の移動や鞭毛打などの運動を司っている(原核生物の鞭毛には微小管は存在しない)。微小管を足場(レール)とするモータータンパク質としてダイニンやキネシンなどが知られている。これらのタンパク質は細胞の巨視的運動のみではなくタンパク質やmRNAといった分子の細胞内局在にも関与しているが、この場合の-端から+端に向けての輸送を順行性、+端から-端に向けての輸送を逆行性として区別され、いずれの輸送も微小管系と細胞質中に存在するモータータンパク質群との相互作用によって起こる。順行性の輸送はキネシンが、逆行性の輸送にはダイニンが重要な役割を果たしているといわれている。
微小管形成の操作
コルヒチンやビンカアルカロイド系の抗がん剤(ビンクリスチンなど)は微小管の伸長を阻害する。タキサン系の抗がん剤(ドセタキセル、パクリタキセル)は逆に解離を阻害し、微小管を極度に安定化する。いずれも分裂装置の主体である微小管の不全をもたらし、細胞分裂を阻害することから分裂毒と呼ばれている。
微小管の重合を阻害する薬剤であるコルヒチンは紡錘糸の形成阻害を起こすことから、果樹では種無し(不稔)の果実を品種改良により作成する際に使用される(種なしスイカ参照)。 また、カタニンによって切断される。
関連項目
MAP2>>完全コピペです
佐藤 啓介、寺田 純雄
東京医科歯科大学 医歯薬学総合研究科 神経機能形態学分野
DOI:10.14931/bsd.4347 原稿受付日:2013年10月31日 原稿完成日:2014年4月28日
担当編集委員:柚崎 通介(慶應義塾大学 医学部生理学)
英語名:Microtubule-associated protein 2 英略語:MAP2
MAP2は、脊椎動物のニューロンに豊富に存在する微小管結合タンパク質である。古典的MAPs(Microtubule Associated Proteins)、もしくは構造的MAPsと呼ばれる一群の微小管結合タンパク質のグループに属する。MAP2遺伝子にコードされ、複数のスプライシング変異体が存在する。MAP2自身の微小管への直接的な作用および他のタンパク質を微小管にリクルートすることによる間接的な作用により、微小管の重合状態や構造安定性を調節する機能を持つ考えられている。神経前駆細胞から分化すると発現し始め、成熟したニューロンでは軸索には殆ど存在せず樹状突起と細胞体にほぼ特異的に局在する。
| Microtubule-associated protein 2 | |||||
|---|---|---|---|---|---|
| Identifiers | |||||
| Symbols | MAP2; MAP2A; MAP2B; MAP2C | ||||
| External IDs | OMIM: 157130 MGI: 97175 HomoloGene: 1779 GeneCards: MAP2 Gene | ||||
| |||||
| RNA expression pattern | |||||
 | |||||
| More reference expression data | |||||
| Orthologs | |||||
| Species | Human | Mouse | |||
| Entrez | 4133 | 17756 | |||
| Ensembl | ENSG00000078018 | ENSMUSG00000015222 | |||
| UniProt | P11137 | Q3TRF8 | |||
| RefSeq (mRNA) | NM_001039538 | XM_001001964 | |||
| RefSeq (protein) | NP_001034627 | NP_001035023 | |||
| Location (UCSC) | Chr 2: 210.29 – 210.6 Mb | Chr 1: 66.18 – 66.38 Mb | |||
| PubMed search | [1] | [2] | |||
構造
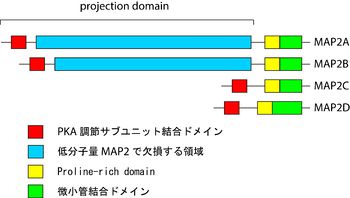
哺乳類には少なくともMAP2A、B、C、Dの4つのスプライシング変異体が存在する[1]。MAP2AとMAP2Bは高分子量でそれぞれ280 kDaと270 kDa、MAP2CとMAP2Dは低分子量でそれぞれ70 kDaと75 kDaである[2]。C末端領域は微小管結合領域を持ち、それより上流はprojection domainと呼ばれる(図参照)。高分子量MAP2と低分子量MAP2の大きさの違いは、主にprojection domainの長さの違いによる。
微小管結合領域は、リン酸化部位となるKXGS motifを含む微小管結合反復配列を持つ。そのすぐN末端側にプロリンに富む領域(Proline-rich domain; PRD)がある。殆どの領域は二次構造を形成しないと考えられているが、N末端に存在するcAMP依存性タンパク質リン酸化酵素 (protein kinase A, PKA)の調節サブユニットとの結合部位は両親媒性のへリックスを形成する[3]。
発現と局在
発生と発現
MAP2は神経前駆細胞から分化すると発現し始める。MAP2Cが最も早く発現し、成熟すると一部の組織を除いて発現がみられなくなる[4]。MAP2Aの発現は発生初期では低いが、MAP2Cの発現が低下する頃に発現が強まり、それ以降は恒常的に発現する[5]。MAP2Bは発生初期から成熟後に至るまで、全ての発生段階で発現している[6]。MAP2Dは、発生段階の小脳や嗅球など特定の部位で強く発現が見られる[7]。
細胞内局在
成熟したニューロンでは、MAP2は樹状突起と細胞体にほぼ特異的に局在し、軸索には殆ど存在しない。このため、免疫染色などで樹状突起を軸索と区別するマーカーとしてよく用いられる。ただし発生初期段階のニューロンにおいて、MAP2Cは細胞体と樹状突起に加えて軸索にも存在する[8]。
ニューロンのマーカーとして使用されるが、ニューロン以外にも下垂体後葉の星状膠細胞(astrocyte)や発現量は低いが希突起膠細胞(oligodendrocyte)にも発現がみられる[9] [10]。また神経系以外でも精巣、卵巣などにも発現する [11] [12]。
機能
微小管動態の制御
微小管は+端において脱重合と伸長を繰り返す、動的不安定性(dynamic instability)と呼ばれる性質を持つ。脱重合から伸長への状態の変化をrescue、伸長から脱重合への状態の変化をcatastropheという。In vitroの研究から、catastropheを抑制することによる微小管の重合の促進や安定化がMAP2の主な機能であると考えられている[13][14]。
また、微小管同士の間隔の調節(spacing)にも寄与しているとされる[15]。神経系以外の細胞にMAP2を発現させると、微小管の束化が起こる[16] [17]。MAP2の二量体形成による微小管同士の架橋や、微小管の剛性・安定性が増加した結果起こる非特異的な束化などがメカニズムとして提唱されている。
この現象の神経系での意義は明らかではないが、細胞レベルでの研究からは微小管結合領域での線維状アクチンとの結合を介して突起の形成に関連する可能性が推測されている[18]。MAP2Cを神経芽細胞腫細胞に発現させると突起の形成を誘導するが、線維状アクチンと結合できない変異体を発現させても突起を形成は誘導されないことから、線維状アクチンへの結合能はMAP2の機能にとって重要であると考えられる[19]。
他タンパク質との相互作用
他のタンパク質を微小管にリクルートするのもMAP2の重要な働きである。
PKAは環状AMP(cAMP)の結合により調節サブユニットが解離することによって活性化されるキナーゼで、ニューロンに存在する様々なタンパク質をリン酸化する。MAP2はPKAの調節サブユニットに結合し、MAP2のノックアウトマウスでは樹状突起のPKAが著しく減少していることから、樹状突起におけるPKAの主要な結合相手はMAP2であると考えられる[20][21][22]。MAP2自身もPKAによってリン酸化される他、PKAを局在化することによりリン酸化を介したシグナリングに寄与していると推測される。
他にも複数のキナーゼやRasの活性制御に関わるタンパク質への結合が見出されているのに加え、MAP2がニューロステロイドの受容体となるという報告もあり、これらのシグナル伝達を介して微小管や樹状突起の構造や動態が制御されていると考えられる[23][24][25]。
リン酸化
MAP2は先述した微小管結合領域のKXGS motifをはじめ多くのリン酸化部位を持ち、実際に様々なキナーゼの基質となる[23]。リン酸化はMAP2の微小管との結合能を低下させることから、MAP2のリン酸化状態を変化させることにより、微小管の動態を調節することができる。実際に、発生の段階によってMAP2のリン酸化状態が変化することが報告されており、ニューロンの形態変化においてMAP2を介した微小管動態の調節が重要であることが示唆される[23]。
ノックアウトマウス
個体レベルでのMAP2の機能については、MAP2のノックアウトマウスが作製、解析されている[26][22]。MAP2ノックアウトマウスでは脳の形態に異常は見られなかったが、海馬ニューロンの樹状突起の短縮や小脳プルキンエ細胞の樹状突起における微小管の密度の低下が観察された。ただし、このノックアウトマウスでは、失われたMAP2の機能が機能的重複を持つ他の古典的MAPsで補償されている可能性がある。これを支持する知見として、古典的MAPsの一つMAP1Bを同時にノックアウトしたMAP2MAP1Bダブルノックアウトマウスでは、出生後間もなく致死となり、脳の層構造の形成や神経突起の伸長に異常が見られるなど、MAP2やMAP1Bの単独ノックアウトマウスと比べて重篤な障害を呈したと報告されている[26]。
関連項目
2024年10月6日 | カテゴリー:基礎知識/物理学、統計学、有機化学、数学、英語, 循環器, 頭頚部症状, 脳神経系疾患 |