オステオポンチンについて
オステオポンチン(Osteopontin, OPN)
またの名を骨シアロ蛋白質I(bone/sialoprotein I, BSP-1,BNSP)、
Tリンパ球活性化1蛋白質[5](early T-lymphocyte activation, Eta-1)、
分泌型リン蛋白質1(secreted phosphoprotein 1, SPP1)、
2ar、
リケッチア耐性因子(Rickettsia resistance, Ric)
は、SPP1 遺伝子でコードされるヒト蛋白質である。
ネズミにおける相同分子はSpp1 。1986年に初めて骨芽細胞で同定されたSIBLING蛋白質(糖蛋白質)である。
接頭辞のオステオ(osteo-)はこの蛋白質が骨で発現していることを示しているが、他の組織でも発現している。接尾辞のポンチン(-pontin)は、ラテン語で橋を意味する“pons”に由来し、オステオポンチンが架橋蛋白質としての役割を担っていることを示す。
オステオポンチンは細胞外構造蛋白質であり、従って骨の有機成分である。
この遺伝子は7つのエクソンを持ち、長さは5千塩基対(5kbp)に及び、ヒトでは4番染色体第22領域(4q1322.1)の長腕に位置している。蛋白質は約300アミノ酸残基からなり、ゴルジ体での翻訳後修飾の際に蛋白質に結合する10個のシアル酸残基を含む約30個の糖鎖が結合している。アミノ酸には酸性のものが多く含まれ、蛋白質の30-36%はアスパラギン酸またはグルタミン酸である。
オステオポンチンは強い負電荷を帯び、高度にリン酸化された細胞外マトリックス蛋白質であり、本質的に無秩序な蛋白質であって大規模な二次構造を欠いている。約300個のアミノ酸(マウスでは297個、ヒトでは314個)からなり、33kDaの新生タンパク質として発現し、機能的に重要な切断部位も含まれる。オステオポンチンは翻訳後修飾を受け、見掛けの分子量は約44kDaに増加する[9]。OPN 遺伝子は7つのエクソンからなり、そのうち6つはコード配列を含む[10][11]。最初の2つのエクソンは5'非翻訳領域(5'UTR)を含む[12]。エクソン2、3、4、5、6、7はそれぞれ17、13、27、14、108、134アミノ酸をコードする。イントロンとエクソンの境界はすべてフェーズ0タイプであるため、選択的エクソンスプライシングによってOPN 遺伝子のリーディングフレームが維持されている。

オステオポンチンの全長(OPN-FL)はトロンビン切断によって修飾され、OPN-Rとして知られる切断型蛋白質上にSVVYGLRという配列が露出する(図1)。このトロンビン切断型OPN(OPN-R)は、α4β1、α9β1、α9β4のインテグリン受容体のエピトープを露出する[14][15]。これらのインテグリン受容体は、肥満細胞、好中球、T細胞など多くの免疫細胞に存在する。単球やマクロファージにも発現している。これらの受容体と結合すると、細胞はいくつかのシグナル伝達経路を用いて、これらの細胞に免疫応答を引き起こす。OPN-RはさらにカルボキシペプチダーゼB(CPB)によってC末端のアルギニンが除去され、OPN-Lとなる。OPN-Lの機能は殆ど不明である。
オステオポンチンの細胞内変種(iOPN)は、遊走、融合、運動性を含む多くの細胞プロセスに関与していると思われる。細胞内OPNは、細胞外アイソフォームの生成に使われるのと同じmRNA種上の選択的翻訳開始部位を用いて生成される[23]。この代替翻訳開始部位はN末端小胞体標的シグナル配列の下流にあるため、OPNの細胞質内翻訳が可能である。
乳癌を含む様々なヒトのがんでは、オステオポンチンのスプライス変種が発現していることが観察されている[24][25]。がんに特異的なスプライス変種は、オステオポンチン-a、オステオポンチン-b、オステオポンチン-cである。オステオポンチン-bはエクソン5を欠き、オステオポンチン-cはエクソン4を欠く。オステオポンチン-cは細胞外マトリックスに結合できないため、ヒト乳癌細胞の足場非依存性表現型を促進することが示唆されている。

オステオポンチンは、心線維芽細胞[26]、前骨芽細胞、骨芽細胞、骨細胞、歯芽細胞、一部の骨髄細胞、肥大した軟骨細胞、樹状細胞、マクロファージ[27]、平滑筋[28]、骨格筋筋芽細胞[29]、内皮細胞、および内耳、脳、腎臓、十二指腸、胎盤の骨外(非骨)細胞など、さまざまな組織型で発現している。オステオポンチンの合成は、カルシトリオール(1,25-ジヒドロキシ-ビタミンD3)により刺激される。
オステオポンチン遺伝子の発現制御はまだ完全には理解されていない。OPN 遺伝子の発現制御機構は、細胞の種類によって異なる可能性がある。骨におけるOPNの発現は、破骨細胞(骨を吸収する細胞)だけでなく、骨芽細胞や骨細胞(骨を形成する細胞)によっても起こる[30]。OPNの発現にはRunx2(別名Cbfa1)とosterix(Osx)転写因子が必要である[31]。Runx2とOsxはCol1α1、Bsp、Opn のような骨芽細胞特異的遺伝子のプロモーターに結合し、転写を上方制御する[32]。
低カルシウム血症および低リン血症(腎近位尿細管細胞を刺激してカルシトリオール(1α,25-ジヒドロキシビタミンD3)を産生させるような場合)は、OPNの転写、翻訳、分泌を増加させる[33]。これは、OPN 遺伝子プロモーターに高特異性ビタミンD応答配列(VDRE)が存在するためである[34][35]。
オステオポンチンの発現はマンソン住血吸虫(Schistosoma mansoni )卵抗原によっても調節される[37]。
マンソン住血吸虫卵抗原は、線維形成促進性分子であるオステオポンチンの発現を直接刺激し、全身のオステオポンチン濃度は疾患の重症度と強く相関することから、罹患バイオマーカーとしての利用が示唆される。慢性マウス住血吸虫症において、プラジカンテル(PZQ)投与が全身オステオポンチン濃度および肝コラーゲン沈着に及ぼす影響を調査した結果、PZQ投与が全身オステオポンチン濃度と肝コラーゲン沈着を有意に減少させることが明らかとなり、オステオポンチンがPZQの有効性および線維症の軽減をモニタリングするための信頼性の高いツールになり得ることが示された[38][37]。
細胞外無機リン酸(ePi)もまた、OPN発現の調節因子として特定されている[39]。
オステオポンチンの発現は、急性炎症の古典的メディエーターである炎症性サイトカイン[40](腫瘍壊死因子α(TNFα)、インターロイキン-1β(IL-1β)など)、アンジオテンシンII、トランスフォーミング増殖因子β(TGFβ)、副甲状腺ホルモン(PTH)[41][42]に細胞が晒された時にも刺激されるが、これらの制御経路の詳細な機序はまだ判っていない。高血糖と低酸素症もオステオポンチンの発現を増加させることが知られている[41][43][44]。
オステオポンチンは多くの状況において重要な抗アポトーシス因子である。オステオポンチンは、有害な刺激に晒された線維芽細胞や内皮細胞だけでなく、マクロファージやT細胞の活性化による細胞死を阻止する[45][46]。オステオポンチンは炎症性大腸炎における非プログラム細胞死を妨げる[47]。
オステオポンチンは分泌型酸性蛋白質(SIBLINGs[注 1])ファミリーに属し、そのメンバーはAspやGluなどの負電荷を帯びたアミノ酸を豊富に含む[48]。オステオポンチンはまた、翻訳後にSer残基をリン酸化してホスホセリンを形成するためのコンセンサス配列部位も多数持っており、更なる負電荷を与える[49]。オステオポンチンの中で高陰性電荷を持つ一連の連続領域は同定され、polyAspモチーフ(ポリアスパラギン酸)およびASARMモチーフ[注 2]と命名されており、後者の配列には複数のリン酸化部位がある[50][51][52][53]。オステオポンチンのこの全体的な負電荷は、その特異的な酸性モチーフ、およびオステオポンチンが本質的に無秩序な蛋白質[54][7]でありオープンでフレキシブルな構造が可能であるという事実とともに、オステオポンチンが様々な生体鉱物中の結晶表面に存在するカルシウム原子に強く結合することを可能にしている[53][55][56]。骨や歯に含まれるリン酸カルシウム[57]、内耳の耳石や鳥類の卵殻に含まれる炭酸カルシウム[58][59]、腎臓結石に含まれるシュウ酸カルシウム[60][61][62]など、さまざまな種類のカルシウム系生体鉱物へのオステオポンチンの結合は、一過性の石灰化前駆体相を安定化させることにより、また結晶表面に直接結合することにより、石灰化阻害剤として作用し、これらすべてが結晶成長を制御する[63][64][65]。
オステオポンチンは多くの酵素の基質蛋白質であり、その酵素の作用がオステオポンチンの石灰化抑制機能を調節している可能性がある。PHEX[注 3]はそのような酵素の一つで、オステオポンチンを広範に分解し、その不活性化遺伝子変異(X連鎖性低リン血症、 XLH)では、オステオポンチンの制御が変化するため、石灰化を抑制するオステオポンチンが分解されず、骨(および歯)の細胞外マトリックスに蓄積し、XLHに特徴的な骨軟化症(骨が軟らかい低石灰化骨、歯が軟らかい歯軟化症)を局所的に引き起こす[66][67][13]。オステオポンチンが関与する局所的で生理的な二重陰性(阻害作用阻害剤)石灰化制御を説明する関係は、石灰化の型板原理と呼ばれており、酵素-基質ペアが石灰化阻害剤(例えば、ピロリン酸阻害を解除する組織非特異的アルカリホスファターゼ(TNAP)、オステオポンチン阻害を解除するPHEX)を分解することにより、細胞外マトリックスに石灰化パターンを刻印する(最も顕著に骨について記述されている)[68][65]。石灰化疾患との関連では、型板原理は特に、低ホスファターゼ症やX連鎖性低ホスファターゼ症で観察される骨軟化症や歯軟化症に関連している。
オステオポンチンは、骨や歯の細胞外マトリックス内の正常な石灰化の制御におけるその役割とともに[69]、尿路結石[60][62]や血管石灰化[70][71]などの病的な異所性石灰化[71][72]の部位でも発現が亢進しており、おそらく少なくとも部分的には、これらの軟部組織における消耗性疾患に関する石灰化を抑制するためであろう[訳語疑問点]。
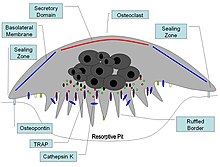
オステオポンチンは骨再形成に重要な因子として関与している[73]。具体的には、オステオポンチンは破骨細胞を骨表面に固定し、その石灰結合特性により固定化され、RGDモチーフを破骨細胞のインテグリン結合に利用することで、細胞の接着と移動を可能にする[16]。骨表面のオステオポンチンは薄い有機層、いわゆる境界膜[注 4]に存在する[74]。骨の有機成分は乾燥重量の約20%で、オステオポンチン以外に、I型コラーゲン、オステオカルシン、オステオネクチン、アルカリホスファターゼが含まれる。コラーゲンI型は蛋白質量の90%を占める。骨の無機質部分は水酸燐灰石という鉱物で、Ca10(PO4)6(OH)2である。食事からカルシウムが供給されないと骨はカルシウム不足に陥るため、骨粗鬆症になる可能性がある。
オステオポンチンは、破骨細胞が骨吸収を開始するにあたり、その波状縁を形成するプロセスを開始する役割を果たす。オステオポンチンはRGDインテグリン結合モチーフを持つ。
活性化T細胞はIL-12によってTh1型への分化が促進され、IL-12やIFNγなどのサイトカインを産生する。オステオポンチンはTh2サイトカインであるIL-10の産生を抑制し、Th1反応を亢進させる。オステオポンチンは細胞性免疫に影響を及ぼし、Th1サイトカインとしての機能を持つと共に、B細胞の免疫グロブリンの産生と増殖を促進する[8]。オステオポンチンはまた、肥満細胞の脱顆粒を誘導する[75]。IgEを介したアナフィラキシーは、OPNノックアウトマウスでは野生型マウスに比べて有意に減少する。OPN産生腫瘍はOPN欠損腫瘍に比べてマクロファージの活性化を誘導できることから、マクロファージの活性化におけるオステオポンチンの役割は、がんにも関係しているとされる[76]。

オステオポンチンはアルコール性肝疾患における好中球の動員において重要な役割を果たしている[17][77]。オステオポンチンは試験管内での好中球の遊走に重要である[78]。加えて、オステオポンチンは関節リウマチのコラーゲン関節炎モデルにおいて、炎症細胞を関節炎関節に動員する[79][80]。2008年に行われた最近のin vitro 研究では、オステオポンチンが肥満細胞の遊走に関与していることが明らかにされた[75]。オステオポンチンをノックアウトした肥満細胞を培養したところ、野生型肥満細胞に比べて走化性が低下していることが観察された。オステオポンチンはマクロファージの走化性因子としても働くことが判明した[81]。アカゲザルでは、オステオポンチンはマクロファージが脳内の集積部位から離れるのを阻止し、しかし走化性を亢進させていることが示された。
オステオポンチンは、白血球が発現するα4β1、α9β1、α9β4などのインテグリン受容体に結合する。これらの受容体は、白血球の細胞接着、遊走、生存について機能することが立証されている。
オステオポンチンは、マクロファージ、好中球、樹状細胞、ミクログリア、T細胞、B細胞など、様々な免疫細胞で発現しており、その動態は様々である。オステオポンチンは様々な形で免疫調節因子として働くことが報告されている[8]。まず、オステオポンチンには走化性があり、炎症部位への細胞の動員を促進する。オステオポンチンは接着蛋白質としても機能し、細胞接着や創傷治癒に関与する。さらに、オステオポンチンは細胞の活性化とサイトカイン産生を仲介し、アポトーシスを制御して細胞の生存を促進する[8]。
オステオポンチンは、遍在的に発現する複数の細胞表面受容体と相互作用することで、創傷治癒、骨代謝、腫瘍形成、炎症、虚血、免疫応答など、多くの生理的・病理学的プロセスに積極的に関与している。血漿(または局所)オステオポンチン濃度の変更は、自己免疫疾患、がん転移、骨(および歯)の石灰化関連疾患、骨粗鬆症、およびある種のストレスの治療に有用であろう[8]。
オステオポンチンは関節リウマチの病因に関与している。オステオポンチンのトロンビン切断型であるOPN-Rは関節リウマチ罹患関節で上昇する。しかし、関節リウマチにおけるオステオポンチンの役割はまだ不明である。あるグループはOPNノックアウトマウスが関節炎から保護されることを発見したが[82]、他のグループはこの観察を再現できなかった[83]。
オステオポンチンは、自己免疫性肝炎、アレルギー性気道疾患、多発性硬化症など、他の自己免疫疾患にも関与していることが知られている[84]。
オステオポンチンは最近、アレルギー性炎症や喘息と関連していると考えられている。オステオポンチンの発現は、喘息患者の肺上皮および上皮下細胞において、健常人と比較して有意に増加しており[85]、またアレルギー性気道炎症を起こしたマウスの肺でも上昇している[85]。オステオポンチンの分泌型(OPN-s)は、アレルゲン感作(OVA/Alum[注 5])時に炎症促進的な役割を果たし、この段階でOPN-sを中和すると、アレルギー性気道炎症が有意に軽快する[85]。対照的に、抗原に晒されている段階でのOpn-sの中和はアレルギー性気道疾患を悪化させる[85]。OPN-sのこれらの作用は、主に一次感作期にはTh2抑制性形質細胞様樹状細胞(DC)の制御によって、二次抗原投与時にはTh2促進性通常型DCの制御によって媒介される[85]。オステオポンチン欠乏はまた、気道リモデリングの慢性抗原曝露モデルを用いて、リモデリングと気管支過感受性(BHR)を抑制することが報告された[86]。さらに最近、オステオポンチンの発現がヒト喘息で上昇し、リモデリングの変化と関連し、その上皮下発現が疾患の重症度と相関することが示された[87]。オステオポンチンはまた、喫煙喘息患者の喀痰上清[88]や、対照となる喫煙者および非喫煙喘息患者の気管支肺胞洗浄液および気管支組織で増加することが報告されている[89]。
大腸炎[編集]
オステオポンチンは炎症性腸疾患(IBD)で発現が上昇する[90]。オステオポンチンの発現は、クローン病(CD)および潰瘍性大腸炎(UC)患者の腸管免疫細胞および非免疫細胞、血漿、ならびに実験的大腸炎マウスの大腸および血漿で非常に上昇している[90][91][92]。血漿中オステオポンチン濃度の増加はCDの炎症の重症度と関連しており、特定のOPN遺伝子(Spp1)ハプロタイプはCD感受性の修飾因子である。オステオポンチンはまた、IBDのマウスモデルであるTNBS・DSS[注 6]誘発大腸炎においても炎症促進作用を示す。オステオポンチンはマウス腸間膜リンパ節(MLN)由来の特定の樹状細胞(DC)サブセットで高度に発現し、大腸炎において炎症促進性が強いことが判明した[93]。樹状細胞は、ヒトのIBDや実験的大腸炎マウスにおける腸炎の発症に重要である。この炎症性MLN樹状細胞サブセットによるオステオポンチン発現は、大腸炎時の病原性作用に極めて重要である[93]。
オステオポンチンがIL-17産生を促進することが示されており[94]、肺癌、乳癌、結腸直腸癌、胃癌、卵巣癌、甲状腺乳頭癌、悪性黒色腫、胸膜中皮腫などの様々な癌で過剰発現している他、糸球体腎炎および尿細管間質性腎炎の両方に寄与している。また、動脈内のアテローム斑に認められる。従って、血漿オステオポンチン濃度の操作は、自己免疫疾患、癌転移、骨粗鬆症、およびある種のストレスの治療に有用であろうと思われる[8]。
オステオポンチンはPDAC(膵臓腺癌)の病勢進行に関与している[95]。PDACでは3つのスプライス変異が発現し、オステオポンチン-aはほぼ全てのPDACで発現する他、オステオポンチン-bの発現は生存率と相関し、オステオポンチン-cの発現は転移病変と相関する。PDACではオステオポンチンが交互にスプライシングされた形で分泌されるため、腫瘍特異的、病期特異的な標的設定が可能である。PDACにおけるオステオポンチンシグナル伝達の正確なメカニズムは不明であるが、オステオポンチンはCD44およびインテグリンと結合し、腫瘍の進行や補体阻害などのプロセスを引き起こす。オステオポンチンはまた、血管内皮増殖因子(VEGF)とマトリックスメタロプロテアーゼ(MMP)の放出を誘発することによって転移を促進するが、これはオステオポンチンをノックダウンすることによって抑制される。この過程はニコチンによっても刺激され、喫煙者が膵癌リスクを上昇させるメカニズムとして提唱されており、膵癌のマーカーとして研究されている。オステオポンチンは、膵管内乳頭粘液性腫(IPMN)や切除可能な(初期の)PDACと膵炎との鑑別において、CA19-9よりも優れていることが判明している。hu1A12などの抗オステオポンチン抗体は、in vivo 試験で転移を抑制し、抗VEGF抗体ベバシズマブとの混用(併用?)でも転移を抑制した。少なくとも1つの臨床試験では、腫瘍内低酸素状態のマーカーとしてのオステオポンチンの使用が検討されている。しかし、このマーカーは比較的未解明のままである[96]。
オステオポンチンは過剰な瘢痕形成にも関与しており、その影響を抑制するゲルが開発された[97]。
オステオポンチンを阻害する抗オステオポンチンモノクローナル抗体薬AOM1は、非小細胞肺癌(NSCLC)のマウスモデルにおいて、大きな転移性腫瘍の進行を阻止することが期待された[98][99]。
オステオポンチンは転移を促進し、癌のバイオマーカーとして使用される可能性があるが、最新の研究では、腫瘍の発生過程において、この分子が自然免疫細胞集団を保護する機能があることが新たに報告された。特に、最適な免疫機能を持つナチュラルキラー(NK)細胞のプールを維持することは、がん腫瘍形成に対する宿主の防御にとって極めて重要である。米国科学アカデミー紀要に掲載された研究によれば、iOPN[注 7]は機能的なNK細胞の増殖を維持するために不可欠な分子である。iOPNが欠乏すると、正常なNK細胞質を維持できなくなり、サイトカインIL-15による刺激後に細胞死が増加する。オステオポンチン欠乏NK細胞は免疫応答の収縮期をうまく通過できず、その結果、長寿命NK細胞の増加が損なわれ、腫瘍細胞に対する応答に欠陥が生じる[100]。さらに、形質細胞様樹状細胞(pDC)は悪性黒色腫を防止し、この効果はI型IFNによって媒介される[101]。Journal of Cell Biology 誌掲載の研究により、オステオポンチン蛋白質の特異的断片(SLAYGLR)が、pDCを悪性黒色腫の発生から保護するためにより“適合”させ得ることが示された。これは、MyD88遺伝子非依存性で、PI3K/mTOR/IRF3[注 8]経路を介して作動する新規のα4インテグリン/IFN-β軸の活性化によって実現される[102]。
オステオポンチンは正常な状態ではほとんど発現しないが、心臓の機能が低下すると急速に蓄積する[103][104]。特に、心筋梗塞後のリモデリングにおいて中心的な役割を果たしており、肥大型心筋症(HCM)や拡張型心筋症(DCM)では劇的に発現が上昇する[104]。一旦増加すると、血管新生、サイトカインの局所産生、筋線維芽細胞の分化、細胞外マトリックスの沈着の増加、心筋細胞の肥大など、心筋の広範な生理的変化を惹起する。これらを総合すると、心臓の構造がリモデリングされ、実質的に心臓の正常な機能が低下し、心不全のリスクが増加する[105][106]。
オステオポンチンは酸化・ニトロソ化ストレス、アポトーシス、ミトコンドリア機能障害、興奮毒性に関与しており、これらはパーキンソン病(PD)の病態にも関与している。PD患者の血清および脳脊髄液中のオステオポンチン濃度を調べたところ、PD患者では体液中のオステオポンチン濃度が上昇していることが示された[107]。
オステオポンチンがデュシェンヌ型筋ジストロフィーのような骨格筋疾患において多くの役割を果たしていることを示唆する証拠が蓄積されつつある。オステオポンチンは、筋ジストロフィーや傷害を受けた筋の炎症環境の構成要素として報告されており[29][108][109][110]、また、老化した筋ジストロフィーマウスの横隔膜筋の瘢痕化を増加させることも示されている[111]。最近の研究で、オステオポンチンがデュシェンヌ型筋ジストロフィー患者の重症度を決定する因子であることが判明した[112]。この研究では、低濃度のオステオポンチン発現を引き起こすことが知られているオステオポンチン遺伝子プロモーターの変異が、デュシェンヌ型筋ジストロフィー患者における歩行や筋力喪失までの年齢の低下と関連していることが明らかにされ
特発性変形性股関節症患者では、血漿中オステオポンチン濃度の上昇が観察されている。さらに、血漿中オステオポンチン濃度と疾患の重症度との相関も指摘されている[113]
オステオポンチンは着床時に子宮内膜細胞に発現する。卵巣によるプロゲステロンの産生により、オステオポンチンは着床を補助するために大幅に上方制御される。子宮内膜は脱落膜化を受ける必要があり、この過程では、子宮内膜が着床の準備をするために変化し、胚の付着に繋がる。子宮内膜には、胚が付着するのに最適な環境を作り出すために分化する間質細胞が存在する。オステオポンチンは間質細胞の増殖と分化に不可欠な蛋白質であり、αvβ3受容体に結合して接着を助ける。オステオポンチンは脱落膜化とともに、最終的に初期胚の着床を成功に導く。OPN遺伝子がノックアウトされると、母体-胎児間の接着が不安定になる[114][115]。
2024年7月12日 | カテゴリー:基礎知識/物理学、統計学、有機化学、数学、英語, 白血球異常 白血病・骨髄異形成症候群 |





