Human 20S proteasome assembly intermediate structure 3
 8qym homo sapiens
8qym homo sapiens
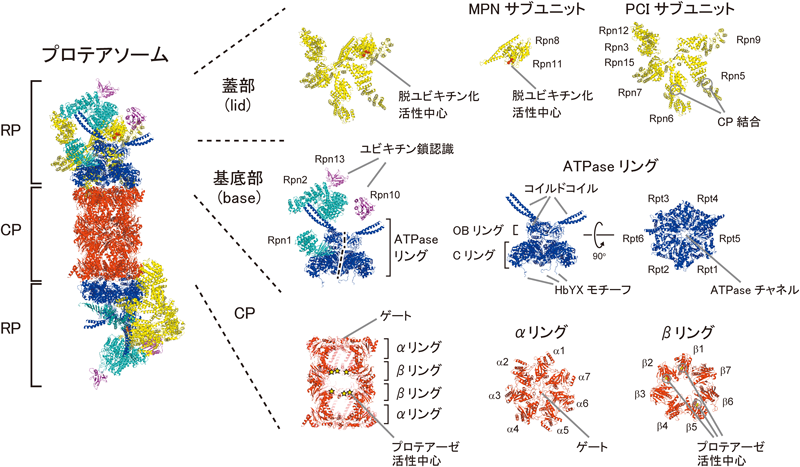
プロテアソームはプロテアーゼ活性を持つ触媒ユニットCP(core particle,別称20Sプロテアソーム)とユビキチン化タンパク質の分解に必須の制御ユニットRP(regulatory particle,別称PA700)が会合した構造を持ち,この活性化型フォームを26Sプロテアソームまたは単にプロテアソームと呼ぶ(余談だが,この26Sの“S”は沈降係数のSであり,CPの片側にRPが会合したRP1-CPは26 S,CPの両端にRPが会合したRP2-CPは30 Sであるため,正確には両者を分けて呼ぶべきであるが,機能に差異があるか不明であり,今のところ慣例的にどちらも26Sプロテアソームと呼ばれている)1,2,4).プロテアソームは非常に不安定な酵素であり,生化学的解析および構造解析が大きく立ち遅れていた.実際,最後の構成サブユニットRpn15/Sem1を筆者らが同定したのは2004年である5).
CPは,出芽酵母およびウシ肝臓由来のものについて結晶構造解析がなされ,触媒活性部位の解明のみならずプロテアソーム阻害剤の開発に貢献してきた10,11).その後,当然の課題として多くの研究者がプロテアソーム全体の結晶化に挑戦したが残念ながらことごとく失敗に終わった.これはプロテアソームが複雑な形状を持つこと,26Sと30 Sを分離することが難しいこと,さらにはPIPsによる試料の不均一性の問題があるためである.このような高難度タンパク質複合体では,結晶構造解析に替わる方法としてクライオ電子顕微鏡による単粒子解析が有効である..現在では,プロテアソームのクライオ電子顕微鏡の密度マップ(7~10 Å)をもとに原子構造モデルが作製されている(図2).その後も,BaumeisterらのグループとUCバークリー校のMartinらのグループが激しく競争しつつも精力的にプロテアソームの構造解析を推進しており,驚異的なスピードで次々と新知見が得られている13,14).
プロテアソームを標的とした薬剤開発
がん細胞はタンパク質毒性ストレスの増大に適応しなくてはならず,正常細胞に比べプロテアソーム要求性が高いことが知られている167).そのため,がん細胞はプロテアソーム阻害剤に高い感受性を示す168,169).現在,プロテアソーム阻害剤のBortezomib(商品名Velcade)とCarfilzomib(同Kyprolis)が難治性の多発性骨髄腫の治療に用いられている170).多発性骨髄腫は骨髄の形質細胞腫瘍であり,血液がんの中で2番目に多く世界で約23万人の患者がいる.まず2003年にBortezomibが多発性骨髄腫の治療薬としてFDAに認可され,現在90か国以上の国で承認されている.Bortezomibはプロテアソーム基質をミミックしたトリペプチドに反応基のボロン酸を付加した可逆性の阻害剤であり,主にキモトリプシン活性を持つβ5を阻害する.BortezomibはMG132など従来のプロテアソーム阻害剤より特異性が高く,NFκBシグナル経路を阻害すると同時に小胞体ストレスを増大させ,がん細胞をアポトーシスに導く.第2世代のプロテアソーム阻害剤Carfilzomibは2012年にFDAに迅速認可された.Carfilzomibはエポキシケトン系の不可逆的阻害剤でプロテアソームに対する選択性が高まっており,Bortezomibに耐性となった多発性骨髄腫にも効果を示す.両剤ともLenalidomide(サリドマイド誘導体),Dexamethasoneとの併用で顕著な奏効率を示す.また,Carfilomibをベースとした経口型プロテアソーム阻害剤MLN9708(商品名ixazomib)も開発されており,すでに臨床第3相試験に入っている.これらのプロテアソーム阻害剤は分子標的薬として大きな成功を収めているが,残念ながら組織分布が悪く血液がんには有効だが固形がんにはほとんど効果がない.また,副作用として血小板減少や末梢神経障害などが高頻度で起こるため,さらなるプロテアソーム阻害剤の開発が進められている.
現在,RPを標的とした二つの阻害剤が報告されている.RA190はユビキチン受容体サブユニットRpn13と共有結合することでプロテアソームのユビキチン化タンパク質分解活性を阻害する171).また,プロテアソームの脱ユビキチン化酵素USP14とUCH37の活性を阻害する化合物としてb-AP15が報告されている.正確な作用機序は不明であるが,b-AP15はRPに結合し構造変化を促すことでUSP14とUCH37の両方を阻害する172).RA190とb-AP15はともにBortezomib耐性の骨髄腫や固形がんの動物モデルで効果を示しており,新しい作用機序のプロテアソーム阻害剤として注目されている169).
一方,プロテアソーム標的薬開発の新しい戦略として,プロテアソーム活性を亢進させることにより細胞内の異常タンパク質を積極的に除去するというものがある.先に述べたように脱ユビキチン化酵素USP14はプロテアソーム上でポリユビキチン化基質のユビキチン鎖を除去することでプロテアソーム分解を阻害する.そこで,FinleyらはUSP14の特異的阻害剤IU1を開発し,細胞レベルではあるが易凝集性タンパク質のtauやTDP43などの分解を促進させることに成功している81).つまりUSP14阻害剤はプロテアソーム活性化剤となる.現在,Proteostasis Therapeutics社によりIU1誘導体が開発されており,神経変性疾患の予防・治療薬として前臨床試験に入っている169).
このように従来型のプロテアソーム阻害剤に加え新しい作用機序のプロテアソーム調節薬の開発が進んでいる.プロテアソームの詳細な構造や作動機構,分子集合機構に関する知見はさらにこの動きを加速させるものと思われる.特にプロテアソームの専用シャペロンの阻害剤やmiRNA-101の補充などもプロテアソームレベルの調節剤として魅力的である99).
2024年5月14日 | カテゴリー:AUTODOCK VINA,CLUS PRO/BIOINFORMATICS, 創薬/AUTODOCKとPYMOLと分子設計 |





