ヒスタミンについて


ヒスタミンはヒスチジン脱炭酸酵素(HDC) により必須アミノ酸であるヒスチジンから合成され、主にヒスタミン-N-メチル基転移酵素やジアミン酸化酵素等で分解され、その後、イミダゾール酢酸となり排出される。肥満細胞中に高濃度で存在し、肺・肝臓・胃粘膜・大脳にも存在し、それぞれの生理機能を担っている。
ヒスチジン脱炭酸酵素の補酵素としては、ビタミンB6の活性型であるピリドキサールリン酸がある。また、ヒスタミン合成を防ぐものとしては、ヒスチジン脱炭酸酵素の阻害を行うカテキン類、メシアダノール、ナリンゲニン、トリトクアリンなどが存在する。一部の真菌はヒスタミン遊離を促し、アトピー性皮膚炎を亢進する[11]。一方リンゴポリフェノールは、ヒスタミン遊離を抑制し、アレルギー性鼻炎の症状を緩和する。
ヒスタミンの代謝には、ジアミンオキシダーゼ (DAO)による経路と、ヒスタミン-N-メチルトランスフェラーゼ (HNMT)による経路が存在する。
ジアミンオキシダーゼ (DAO)は銅を含む酵素であり、銅輸送タンパク質のセルロプラスミンはその活性を行うとされている[17] (なお、セルロプラスミンはエストロゲンによって増加するとされる)。また、ニジマスにおける実験では、ステビアに含まれるカリウムがDAOを活性化するとされた[18]。
ヒスタミン-N-メチルトランスフェラーゼ (HNMT)による経路は、活性メチオニンであるS-アデノシルメチオニン (SAM)を消費する
肥満細胞のほか、好塩基球やECL細胞がヒスタミン産生細胞として知られているが、普段は細胞内の顆粒に貯蔵されており、細胞表面の抗体に抗原が結合するなどの外部刺激により細胞外へ一過的に放出される。また、マクロファージ等の細胞ではHDCにより産生されたヒスタミンを顆粒に貯蔵せず、持続的に放出することが知られている。
血圧降下、血管透過性亢進、平滑筋収縮、血管拡張、腺分泌促進などの薬理作用があり、アレルギー反応や炎症の発現に介在物質として働く。ヒスタミンが過剰に分泌されると、ヒスタミン1型受容体(H1受容体)というタンパク質と結合して、蕁麻疹やアレルギー性疾患の原因となる。
神経組織では神経伝達物質として働き、音や光などの外部刺激および情動、空腹、体温上昇といった内部刺激などによっても放出が促進され、オキシトシン分泌や覚醒状態の維持、食行動の抑制、記憶学習能の修飾など、生理機能を促進することで知られている。
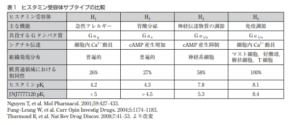
ヒスタミンは特異的な受容体を介してその作用を発揮する。現在のところ4種のGタンパク質共役型受容体が発見されており、受容体によりヒスタミンが結合したときの作用が異なる。ヒスタミン受容体の作用を抑えるのが抗ヒスタミン薬であるが、成分によって抗アレルギー、胃酸抑制の作用を示す。
- H1型--平滑筋、血管内皮細胞や中枢神経などで発現し、炎症やアレルギー反応に関わる。
- H2型--消化管の細胞などで発現し胃酸分泌反応に関わる。
- H3型--中枢神経系などで発現し、ヒスタミン、セロトニン、ノルアドレナリンなどの神経伝達物質の放出を促進する。
- H4型--2000年にクローニングされた。胸腺、脾臓、小腸などで発現が確認されている。H1受容体拮抗薬で抑えられない痒みにH4受容体が関与しているのではないかといわれているが、詳細な働きはまだわかっていない。
- The seminal work on histamine was published in 1910, but histamine was not identified as a mediator of anaphylactic reactions until 1932. Research later showed that histamine is a major mediator responsible for the symptoms of allergic rhinitis, with its activities mediated through 4 G protein-coupled receptors. Most of histamine's effects are exerted through the H₁ receptor, but some effects are through the H₂ and H₃ receptors, and possibly also through the H₄ receptor./// doi: 10.1016/j.anai.2010.08.005. Epub 2010 Sep 16
- Histamine is one of the best-characterized pruritogens in humans. It is known to play a role in pruritus associated with urticaria as well as ocular and nasal allergic reactions. Histamine mediates its effect via four receptors. Antihistamines that block the activation of the histamine H₁receptor, H₁R, have been shown to be effective therapeutics for the treatment of pruritus associated with urticaria, allergic rhinitis, and allergic conjunctivitis. However, their efficacy in other pruritic diseases such as atopic dermatitis and psoriasis is limited. The other histamine receptors may also play a role in pruritus, with the exception of the histamine H₂receptor, H₂R. Preclinical evidence indicates that local antagonism of the histamine H₃receptor, H₃R, can induce scratching perhaps via blocking inhibitory neuronal signals. The histamine H₄receptor, H₄R, has received a significant amount of attention as to its role in mediating pruritic signals. Indeed, it has now been shown that a selective H₄R antagonist can inhibit histamine-induced itch in humans. This clinical result, in conjunction with efficacy in various preclinical pruritus models, points to the therapeutic potential of H₄R antagonists for the treatment of pruritus not controlled by antihistamines that target the H₁R. DOI: 10.1007/978-3-662-44605-8_15
Background: Histamine is a potent mediator of itch in humans, yet histamine H(1) receptor antagonists have been shown to be of limited use in the treatment of certain chronic pruritic diseases. The histamine H(4) receptor is a recently described histamine receptor, expressed on hematopoietic cells, linked to the pathology of allergy and asthma.
Objective: The contribution of the novel histamine H(4) receptor to histaminergic and allergic pruritus was investigated.
Results: Histamine and a selective histamine H(4) receptor agonist caused scratching responses in mice, which were almost completely attenuated in histamine H(4) receptor knockout mice or by pretreatment with the selective histamine H(4) receptor antagonist, JNJ 7777120. Pruritus induced by allergic mechanisms was also potently inhibited with histamine H(4) receptor antagonist treatment or in histamine H(4) receptor knockout mice. In all cases, the inhibitory effect of histamine H(4) receptor antagonist was greater than those observed with histamine H(1) receptor antagonists. The histamine H(4) receptor-mediated pruritus was shown to be independent of mast cells or other hematopoietic cells and may result from actions on peripheral neurons.
Conclusion: These results demonstrate that the histamine H(4) receptor is involved in pruritic responses in mice to a greater extent than the histamine H(1) receptor.
Clinical implications: Histamine H(4) receptor antagonists may have therapeutic utility for treating chronic pruritic diseases in humans where histamine H(1) receptor antagonists are not effective.///
- 一般に掻痒は,痒みのメディエーターが表皮と真皮の境界領域において一次感覚神経を刺激して発生する末梢性掻痒と,モルヒネやβエンドルフィンが中枢のオピオイドμ受容体を介して誘発する中枢性掻痒に大別される.末梢性掻痒は,様々な皮膚疾患における共通の症状として,また中枢性掻痒は,肝硬変,腎不全など種々の原疾患を背景として生じる.痒みの研究は一世紀にわたり行われているが(44),その仕組みが複雑な上,動物を用いた評価法が存在しなかったために研究の進展が遅れていた.1995 年に倉石らが,マウス
において痒みの優れた評価法を報告してから(45)掻痒の研究は急速に前進し,痒みメディエーターとして古くから知られるヒスタミンの他,トリプターゼ,ロイコトリエン B4,サブスタンス P(46),一酸化窒素(47),過酸化水素(48),オピオイドペプチド(49)など,様々な痒みメディエーターが存在し,掻痒反応に関与していることが明らかとされてきた.近年新たに,H4受容体が痒み受容体として掻痒反応に関与している可能性が高まってきた.すなわち,ヒスタミンおよびH4受容体作用薬はいずれも掻痒反応を誘発し50),この掻痒反応はH4 受容体遮断薬もしくはH4 受容体ノックアウトマウスにより抑制されることが確認されたのである(51).H4 受容体の痒み受容体としての作用点は現時点で
不明であるが,マスト細胞欠損マウスに対し H4 受容体作用薬を皮内投与しても野生型と同様の掻痒反応が見られることから(51),H4 受容体を介して誘発する掻痒反応においてマスト細胞の関与は小さいと思われる.H4 受容体作用薬を皮内投与して誘発する掻痒反応は,H4 受容体ノックアウトマウスで抑制されるが,このマウスに野生型マウスの骨髄細胞を移植しても,掻痒反応が回復しないことから(51),H4 受容体を介する掻痒反応は血球系細胞を介しておらず,その作用点としてケラチノサイトなどの皮膚細胞や,末梢の一次感覚神経細胞が可能性として考えられる.さらに,マスト細胞脱顆粒剤のコンパウンド 48/80がマスト細胞欠損マウスに対し掻痒を惹起するが,マスト細胞が存在しないにもかわらず惹起されるこの反応は,コンパウンド 48/80 の一次感覚神経に対する直接刺激によると考えられている(52,53).H4 受容体遮断薬が,この掻痒反応を抑制することからH4 受容体遮断薬の作用点が中枢に存在する可能性も考えられる(51).近年,H4 受容体がヒトの小脳,大脳皮質,脳梁,前頭葉,海馬および視床等に発現することが報告され(54),さらに中枢における掻痒情報の処理に関し,視床の H4 受容体を介する機構の存在が推測されている(55).ヒスタミンが誘発する掻痒反応に対して,H4 受容体遮断薬の抑制作用の方が H1 受容体遮断薬に比べ強いとされるが(51),我々も同様の結果を得ており(37),ヒスタミンが誘発する掻痒反応はH1 に比べH4 受容体の関与が大きいことが示唆された.我々は,H4 受容体遮断薬の抗掻痒作用についてさらに検討すべく,ヒスタミン H1 受容体遮断薬が効果
を示さないサブスタンスP誘発掻痒に対し(56),H4 受容体遮断薬の抗掻痒作用を検討した.その結果,H4受容体遮断薬の JNJ7777120 はサブスタンス P が誘発
する掻痒反応を,用量依存的に有意に抑制することを確認した(37)(図 1).サブスタンス P で誘発される掻痒反応については,安東の優れた総説があるが(48),マスト細胞欠マウスを用いた検討結果より,マスト細胞-ヒスタミン系の関与は小さいこと,サブスタンス P の一次感覚神経に対する直接刺激と,ケラチノサイトが産生するロイコトリエン B4 一次感覚神経刺激作用が重要であると考えられ,さらにケラチノサイトが産生する一酸化窒素が掻痒の増強因子として(47),過酸化水素が起痒因子として関与することが報告されている(48).H4 受容体遮断薬の抗掻痒作用の機序として,すでに発現が確認されているケラチノサイト上の H4 受容体を介し(37),サブスタンス P 刺激に伴いケラチノサイトが産生する上記メディエーター放出に関与している可能性が考えられ,現在機序の解明に向け検討を進めている
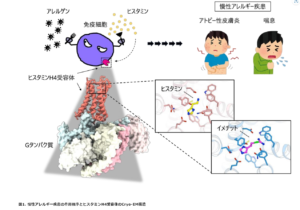
アトピー性皮膚炎と喘息は、花粉症と同様に代表的なアレルギー疾患です。アトピー性皮膚炎は、皮膚のバリア機能の低下によるかゆみを伴う湿疹が全身に現れるのが特徴であり、喘息は、慢性的な炎症から気管支が狭くなったことによる呼吸困難を伴う咳が特徴です。これらのアレルギー疾患は、外部からのアレルゲン (アレルギー症状を起こす物質) の侵入により免疫細胞が過剰に刺激されることで発症すると考えられていますが、これらの発症メカニズムはまだ解明されておらず、症状を緩和させる対処療法しかないのが現状です。
Gタンパク質共役受容体 (GPCR)であり、4種類あるヒスタミン受容体の中で最後に見つけられたヒスタミンH4受容体 (H4R) は、主に好酸球や肥満細胞などの炎症細胞に発現しており、これらの炎症部位への走化と炎症物質 (サイトカインなど) の放出に関与しています。それによって主要な炎症細胞が組織部位に動員されやすくなり、慢性炎症が引き起こされると考えられています。そのため、H4Rはアトピー性皮膚炎や喘息など慢性アレルギー疾患の新規治療標的として注目されており、H4Rを標的とした新しい治療薬の開発が試みられていますが、未だ効果的な治療薬は存在していません。本研究は今まで未知であったH4Rの立体構造を明らかにすることに成功しました。また、内因性炎症物質であるヒスタミンが結合したH4Rの構造とH4R選択的作動薬のイメチットがどのようにH4Rに結合しているのかを明らかにすることで、2つの異なる薬理学特徴を構造から説明することができました。特に、H4Rの1つのアミノ酸 (Phe344) の構造変化が、「Aromatic slot」を形成することがイメチットの結合および選択性において重要な役割を果たしていることが分かりました。アトピー性皮膚炎や喘息の発症に重要な役割を担っているヒスタミンH4受容体 (H4R) の立体構造が明らかになることで、これらの疾患の治療法確立に貢献できると考えられます。
研究手法・成果
本研究において私たちは、生体アミンであるヒスタミンおよびH4R選択的作動薬のイメチットが結合したH4Rの立体構造をCryo-EM単粒子解析法により原子レベルで解明しました。Cryo-EMは、タンパク質の立体構造を決定する革新的技術として2017年にノーベル化学賞を受賞した方法です。Cryo-EMは、膜タンパク質の構造決定法として非常に強力な技術であり、私たちのH4RのようなGPCRを含む多くの膜タンパク質の構造決定に利用されています。私たちはスクリーニング測定用と本測定用の2種類のクライオ透過型電子顕微鏡 (cryo-TEM) を用いた効率的な構造決定法を確立しました。スクリーニングCryo-EMでは京都大学医生物学研究所に設置されているGlacios cryo-TEMを用いて野田岳志 教授、杉田征彦 准教授らと、本測定Cryo-EMでは大阪大学蛋白質研究所のTitan Krios cryo-TEMを用いて加藤貴之 教授、岸川淳一 助教 (当時。現在は 京都工芸繊維大学応用生物学系 准教授) らと連携し、今回の構造を決定することができました。
ヒスタミンは4種類存在するヒスタミン受容体の全てに結合しますが、イメチットはH4Rにのみに強く結合することが知られています。私たちはヒスタミンとイメチットが結合したH4Rの立体構造を決定しました。これら2つの構造を比べると、4つのアミノ酸残基 (Tyr319、Phe344、Gln347、Trp348) から成る「Aromatic slot」において、H4R選択的作動薬であるイメチットが結合する時にPhe344の向きが変わること、この変化がヒスタミンよりイメチットの結合により適していることを明らかにしました (図2)。さらに、ヒスタミンが結合したH1Rとの比較から、H1Rではアスパラギン (Asn198) であるアミノ酸残基がH4Rではグルタミン酸 (Glu182) となっており、これがヒスタミンに対するH1RとH4Rの結合親和性の差となっていること、また「Aromatic slot」を構成するアミノ酸のうち、イメチットの結合に重要なフェニルアラニン (Phe344) がH1Rではイソロイシン (Ile454) となっており、これがイメチットのH4R選択性に重要であることが分かりました (図3)。これらの結果は、薬により結合の仕方に違いがあり、その違いが薬の効果に大きく影響を与える可能性があることを『形』から教えてくれます。このように薬が結合している形を知ることは、薬の最適化につながるものと期待されます。
図2. 内因性炎症物質ヒスタミンとH4R選択的作動薬イメチットが結合したH4Rの構造比較
ヒスタミンとイメチットの結合様式の比較により、ヒスタミンが結合した構造からは見えなかった、4つのアミノ酸からなる「Aromatic slot」の変化が観察されました。特にPhe344が変化することで、H4R選択的作動薬であるイメチットと「Aromatic slot」の相互作用がより強くなっており、これがイメチットのH4Rに対する親和性向上に寄与していることが示されました。
図3. ヒスタミンが結合したH1Rとヒスタミン、イメチットが結合したH4Rの構造比較
これらの構造において、ヒスタミンの結合に重要であるアスパラギン酸 (Asp94/107) はどちらも保存されていますが、イミダゾール環と相互作用するアミノ酸残基 (Glu182/Asn198) に違いがあることが分かりました。ヒスタミンは、全てのヒスタミン受容体と結合しますが、その結合親和性は大きく異なり、H1RよりH4Rに強く結合することが知られています。H4RのGlu182はH1RのAsn198よりヒスタミンと強く相互作用することから、この親和性の差の説明が可能となりました。一方、「Aromatic slot」を構成し、イメチット結合に重要な役割を担うアミノ酸がH1R (Ile454) とH4R (Phe344) で異なっているため、H1Rのスロットとして機能はH4Rに比べて弱いことが明らかとなりました。イメチットはH1Rには結合せず、H4Rに強く結合することが知られていますが、この選択性の差が「Aromatic slot」の違いによるものであることが示されました。
波及効果、今後の予定
今回、私たちが決定したヒスタミンおよびイメチットが結合したH4Rの構造から、H4Rに対する選択性の違いによってH4Rの「Aromatic slot」と名付けた領域の構造が変化し、その結合様式の差が受容体選択性に重要であることを原子レベルで明らかにすることができました。
H4Rはアトピー性皮膚炎や喘息と深い関係がある受容体であると考えられています。そのため、多くの研究が行われておりますが、これらのH4R関連疾患に対する効果的な治療薬は未だ存在しないのが現状です。その最大の原因は、十分な受容体選択性を持つ治療薬の開発が難しいことです。ヒスタミン受容体は4つのサブタイプが存在しており、H4Rだけでなく他のサブタイプに結合することが副作用の要因になります。残念ながら今回構造を決定したイメチットもこの点において不完全な薬剤です。しかし、私たちの構造から提示された結果は、ヒスタミン受容体に対する選択性がどのように生じるのかという問いに対する1つの解答であると考えられます。従って、この違いを利用することでアトピー性皮膚炎などのH4R関連疾患に対してより効果的なH4R選択的薬剤開発が可能になることが期待されます。





