ピーエイ/PA錠について
3.1 組成
| 成分・分量 (1錠中) | サリチルアミド 135mg 日局 アセトアミノフェン 75mg 日局 無水カフェイン 30mg プロメタジンメチレンジサリチル酸塩 6.75mg |
| 添加剤 | 乳糖水和物、ヒドロキシプロピルセルロース、クロスカルメロースナトリウム、タルク、ステアリン酸マグネシウム |



| サリチルアミド アセトアミノフェン 無水カフェイン プロメタジンメチレンジサリチル酸塩 本品は次のメチレンジサリチル酸の誘導体塩の混合物である。 ※1:(2RS)-N,N-ジメチル-1-(10H-フェノチアジン-10-イル)プロパン-2-イラミン5,5'-メチレンジ(2-ヒドロキシベンゾエート) ※2:(2RS)-N,N-ジメチル-1-(10H-フェノチアジン-10-イル)プロパン-2-イラミン3,5'-メチレンジ(2-ヒドロキシベンゾエート) ※3:(2RS)-N,N-ジメチル-1-(10H-フェノチアジン-10-イル)プロパン-2-イラミン3-(3-カルボキシ-4-ヒドロキシベンジル)-5,5'-メチレンジ(2-ヒドロキシベンゾエート) |
薬物動態
16.1 血中濃度
16.1.1 サリチルアミドを健康成人に絶食時単回経口投与したとき、サリチルアミド及びその代謝物は1.5〜2時間以内に最高血漿中濃度に達する5)(外国人データ)。
16.1.2 アセトアミノフェンは10〜60分以内に最高血中濃度に達した後、約8時間後に血中にはほとんど検出できなくなる6)(外国人データ)。
16.1.3 生物学的同等性試験
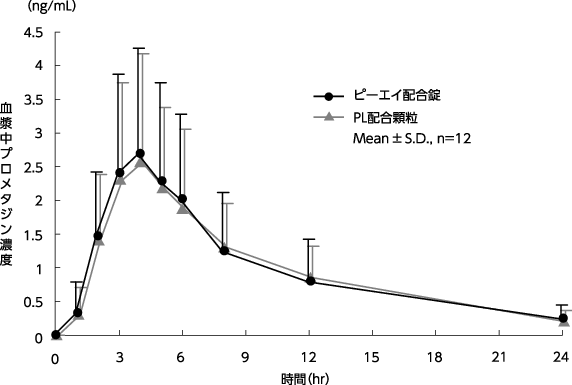
ピーエイ配合錠とPL配合顆粒を、クロスオーバー法によりピーエイ配合錠は2錠、PL配合顆粒は1g(サリチルアミド270mg・アセトアミノフェン150mg・無水カフェイン60mg・プロメタジンメチレンジサリチル酸塩13.5mg)健康成人男子に絶食単回経口投与して各血漿中未変化体濃度を測定し、得られた薬物動態パラメータ(AUC、Cmax)について統計解析を行った結果、両剤の生物学的同等性が確認された7)。

| 判定パラメータ | 参考パラメータ | ||||
| AUC(0→24)(μg・hr/mL) | Cmax(μg/mL) | Tmax(hr) | t1/2(hr) | ||
| サリチルアミド | ピーエイ配合錠 | 10.67±2.76a | 5.05±0.71 | 0.92±0.42 | 1.13±0.39 |
| PL配合顆粒 | 10.30±2.18a | 4.98±1.00 | 0.79±0.26 | 1.19±0.34 | |
| アセトアミノフェン | ピーエイ配合錠 | 9.38±1.59 | 2.21±0.36 | 0.83±0.25 | 2.38±0.49 |
| PL配合顆粒 | 9.52±1.25 | 2.21±0.33 | 0.71±0.33 | 2.34±0.49 | |
| 無水カフェイン | ピーエイ配合錠 | 9.74±2.32 | 1.89±0.34 | 0.88±0.53 | 3.67±1.53 |
| PL配合顆粒 | 10.07±2.81 | 1.94±0.26 | 0.79±0.33 | 3.68±1.05 | |
| プロメタジンメチレンジサリチル酸塩 | ピーエイ配合錠 | 23.76±15.44b | 2.72±1.57c | 3.92±0.51 | 4.48±1.25 |
| PL配合顆粒 | 23.51±12.80b | 2.76±1.58c | 3.92±0.67 | 5.38±1.23 | |

図 サリチルアミドの血漿中濃度推移
図 アセトアミノフェンの血漿中濃度推移
図 無水カフェインの血漿中濃度推移
図 プロメタジンメチレンジサリチル酸塩の血漿中濃度推移
血漿中濃度並びにAUC、Cmax等のパラメータは、被験者の選択、体液の採取回数・時間等の試験条件によって異なる可能性がある。
16.2 吸収
16.3 分布
16.4 代謝
16.4.1 サリチルアミドは通常用量を経口投与後、吸収過程でほとんど完全に不活性代謝物に代謝され、肝臓で初回通過効果を受ける5)。
16.4.2 アセトアミノフェンは肝臓で主にグルクロン酸抱合体、硫酸抱合体に代謝される。また、一部はCYP2E1等により水酸化され、N-アセチル-p-ベンゾキノンイミンとなるが、肝細胞内でグルタチオン抱合を受け、メルカプツール酸となる8)。
16.5 排泄
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 ショック、アナフィラキシー(いずれも頻度不明)
呼吸困難、全身潮紅、血管浮腫、蕁麻疹等があらわれることがある。
11.1.2 中毒性表皮壊死融解症(Toxic Epidermal Necrolysis:TEN)、皮膚粘膜眼症候群(Stevens-Johnson症候群)、急性汎発性発疹性膿疱症、剥脱性皮膚炎(いずれも頻度不明)
11.1.3 薬剤性過敏症症候群(頻度不明)
初期症状として発疹、発熱がみられ、更に肝機能障害、リンパ節腫脹、白血球増加、好酸球増多、異型リンパ球出現等を伴う遅発性の重篤な過敏症状があらわれることがある。なお、ヒトヘルペスウイルス6(HHV-6)等のウイルスの再活性化を伴うことが多く、投与中止後も発疹、発熱、肝機能障害等の症状が再燃あるいは遷延化することがあるので注意すること。
11.1.4 再生不良性貧血、汎血球減少、無顆粒球症、溶血性貧血、血小板減少(いずれも頻度不明)[9.1.1参照]
11.1.6 間質性肺炎、好酸球性肺炎(いずれも頻度不明)
咳嗽、呼吸困難、発熱、肺音の異常等が認められた場合には、速やかに胸部X線、胸部CT、血清マーカー等の検査を実施すること。異常が認められた場合には投与を中止し、副腎皮質ホルモン剤の投与等の適切な処置を行うこと。
11.1.8 乳児突然死症候群(SIDS)、乳児睡眠時無呼吸発作(いずれも頻度不明)
11.1.9 間質性腎炎、急性腎障害(いずれも頻度不明)[9.2参照]
11.1.10 横紋筋融解症(頻度不明)
筋肉痛、脱力感、CK上昇、血中及び尿中ミオグロビン上昇を特徴とする横紋筋融解症があらわれることがあるので、このような場合には投与を中止し、適切な処置を行うこと。
11.1.11 緑内障(頻度不明)
11.2 その他の副作用
| 0.1〜5%未満 | 頻度不明 | |
| 過敏症 | 発疹 | 浮腫、鼻炎様症状、結膜炎 |
| 血液 | チアノーゼ、顆粒球減少、血小板減少、貧血 | |
| 消化器 | 食欲不振、悪心、口渇 | 胸やけ、胃痛、嘔吐、消化管出血 |
| 精神神経系 | 眠気 | めまい、倦怠感、頭痛、耳鳴、難聴、視覚障害、不安感、興奮、神経過敏、不眠、痙攣、せん妄 |
| 肝臓 | 肝機能障害 | |
| 腎臓 | 腎障害 | |
| 循環器 | 血圧上昇、低血圧、頻脈 | |
| その他 | 過呼吸、代謝性アシドーシス、尿閉、発汗、咳嗽、振戦 |
2024年11月3日 | カテゴリー:各種治療学 |